cho m gam kim loại kiềm ta hết trong 100 ml đ h2so4 1M thu được 17,4 gam muối và 4,48 l H2. xác định kim loại và tính m

Những câu hỏi liên quan
Bài 7: Hỗn hợp gồm một kim loại kiềm (hóa trị I) và oxit của nó có khối lượng 19,3 gam tan hết trong nước thoát ra 3,36 lít H2 (đktc) và thu được một dung dịch kiềm. Để trung hòa dung dịch kiềm này cần dùng hết 350 ml H2SO4 1M. Xác định kim loại kiềm.Bài 8: Một hỗn hợp gồm Zn và Fe có khối lượng là 30,7 gam. Hòa tan hỗn hợp này trong 400 ml dung dịch H2SO4 2M.a/ Chứng tỏ rằng hỗn hợp này tan hết.b/ Nếu dùng một lượng hỗn hợp Zn và Fe gấp đôi trường hợp trước, lượ...
Đọc tiếp
Bài 7: Hỗn hợp gồm một kim loại kiềm (hóa trị I) và oxit của nó có khối lượng 19,3 gam tan hết trong nước thoát ra 3,36 lít H2 (đktc) và thu được một dung dịch kiềm. Để trung hòa dung dịch kiềm này cần dùng hết 350 ml H2SO4 1M. Xác định kim loại kiềm.
Bài 8: Một hỗn hợp gồm Zn và Fe có khối lượng là 30,7 gam. Hòa tan hỗn hợp này trong 400 ml dung dịch H2SO4 2M.
a/ Chứng tỏ rằng hỗn hợp này tan hết.
b/ Nếu dùng một lượng hỗn hợp Zn và Fe gấp đôi trường hợp trước, lượng H2SO4 vẫn như cũ thì hỗn hợp mới này có tan hết hay không?
c/ Trong trường hợp (a), hãy tính khối lượng mỗi kim loại trong hỗn hợp biết rằng khi đốt cháy lượng H2 sinh ra trong phản ứng, thì thu được 8,1 gam nước (lượng nước bị hao hụt 10%).
Hoà tan hết kim loại kiềm M trong 500ml dung dịch HCl 1M thu được 42,85 gam chất tan và V lít H2 (đktc). Xác định kim loai M và tính giá trị của V.
Hòa tan hết 11,2 gam kim loại M hóa trị II trong 500 ml dung dịch H2SO4 1M thu được dung dịch A và 4,48 lít H2 (đktc). a/ Xác định M. Fe b/ Tính nồng độ mol của các chất tan trong dung dịch A. 0,6 + 0,4 c/ Làm lạnh dung dịch sau phản ứng A thu được bao nhiêu gam MSO4.7H2O?
a, Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(M+H_2SO_4\rightarrow MSO_4+H_2\)
Theo PT: \(n_M=n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{11,2}{0,2}=56\left(g/mol\right)\)
→ M là Fe.
b, Theo PT: \(n_{FeSO_4}=n_{H_2SO_4\left(pư\right)}=n_{H_2}=0,2\left(mol\right)\)
⇒ nH2SO4 dư = 0,5.1 - 0,2 = 0,3 (mol)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,3}{0,5}=0,6\left(M\right)\\C_{M_{FeSO_4}}=\dfrac{0,2}{0,5}=0,4\left(M\right)\end{matrix}\right.\)
c, Ta có: \(n_{FeSO_4.7H_2O}=n_{FeSO_4}=0,2\left(mol\right)\)
\(\Rightarrow m_{FeSO_4.7H_2O}=0,2.278=55,6\left(g\right)\)
Đúng 1
Bình luận (0)
cho 4,8 gam kim loại m tác dụng hết với dung dịch axit HCL Sau phản ứng thu được 4,48 lít khí H2 (đktc). xác định kim loại M và tính khối lượng muối thu được sau phản ứng
Giả sử KL có hóa trị n.
PT: \(2M+2nHCl\rightarrow2MCl_n+nH_2\)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_M=\dfrac{2}{n}nH_2=\dfrac{0,4}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{4,8}{\dfrac{0,4}{n}}=12n\left(g/mol\right)\)
Với n = 2 thì MM = 24 (g/mol) là tm
Vậy: M là Mg.
Ta có: \(n_{MgCl_2}=n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(\Rightarrow m_{MgCl_2}=0,2.95=19\left(g\right)\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 9,2 gam kim loại kiềm M vào nước thu được dung dịch A và 4,48 lít khí H2 (đktc) Xác định tên kim loại
Xem chi tiết
\(2M+2H_2O\rightarrow2MOH+H_2\)
0,4 mol \(\leftarrow\) 0,2 mol
Khối lượng mol của \(M\) là:
\(M=\dfrac{m}{n}=\dfrac{9,2}{0,4}=23\)
Vậy \(M\) là kim loại \(Na\)
Đúng 2
Bình luận (0)
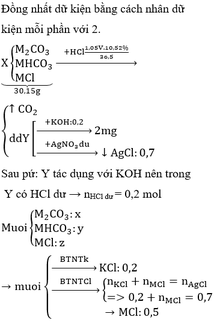
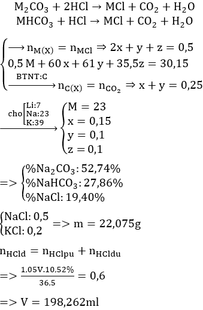
Hỗn hợp X gồm M2CO3, MHCO3, MCl (M là kim loại kiềm). Hòa tan hoàn toàn 30,15 gam hỗn hợp X trong V ml dung dịch HCl 10,52% (D 1,05g/ml) thu được dung dịch Y và 5,6 lít CO2 (đktc). Chia Y thành 2 phần bằng nhau. – Phần 1: tác dụng vừa đủ với 100 ml dung dịch KOH 1M thu được m gam muối. – Phần 2: tác dụng hoàn toàn với dung dịch AgNO3 dư thu được 50,225 gam kết tủa. a. Xác định tên kim loại M. b. Tính thành phần phần trăm theo khối lượng của từng chất trong hỗn hợp X. c. Tính V và m.
Đọc tiếp
Hỗn hợp X gồm M2CO3, MHCO3, MCl (M là kim loại kiềm). Hòa tan hoàn toàn 30,15 gam hỗn hợp X trong V ml dung dịch HCl 10,52% (D = 1,05g/ml) thu được dung dịch Y và 5,6 lít CO2 (đktc). Chia Y thành 2 phần bằng nhau.
– Phần 1: tác dụng vừa đủ với 100 ml dung dịch KOH 1M thu được m gam muối.
– Phần 2: tác dụng hoàn toàn với dung dịch AgNO3 dư thu được 50,225 gam kết tủa.
a. Xác định tên kim loại M.
b. Tính thành phần phần trăm theo khối lượng của từng chất trong hỗn hợp X.
c. Tính V và m.
Cho 8 gam hỗn hợp X gồm Mg và kim loại M vào dung dịch H2SO4 loãng dư, sau khi phản ứng kết thúc thu được 4,48 lít khí H2. Mặt khác 8 gam X tác dụng được tối đa với 5,6 lít Cl2 tạo ra hai muối MgCl2 và MCl3. Xác định kim loại M.
Đọc tiếp
Cho 8 gam hỗn hợp X gồm Mg và kim loại M vào dung dịch H2SO4 loãng dư, sau khi phản ứng kết thúc thu được 4,48 lít khí H2. Mặt khác 8 gam X tác dụng được tối đa với 5,6 lít Cl2 tạo ra hai muối MgCl2 và MCl3. Xác định kim loại M.
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ n_{Cl_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Giả sử M trước H có:
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
x------------------------------->x
\(M+H_2SO_4\rightarrow MSO_4+H_2\)
y------------------------------>y
Có:
\(m_X=24x+Mx=8\\ \Sigma n_{H_2}=x+y=0,2\left(mol\right)\left(1\right)\)
Mặt khác:
\(Mg+Cl_2\rightarrow MgCl_2\)
x---->x
\(2M+3Cl_2\rightarrow2MCl_3\)
y---->1,5y
Có: \(\Sigma n_{Cl_2}=x+1,5y=0,25\left(mol\right)\left(2\right)\)
Từ (1), (2) có hệ phương trình: \(\left\{{}\begin{matrix}x+y=0,2\\x+1,5y=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\Rightarrow24.0,1+0,1M=8\\ \Rightarrow M=56g/mol\)
Giả sử đúng, kim loại M là Fe.
Đúng 3
Bình luận (0)
Hoà tan hoàn toàn 3g hh X gồm một kim loại kiềm và một kim loại kiềm thổ vào nước, thu được dd Y và 1,792 lít H2 (đktc), Trung hòa vừa hết Y bằng V ml dd Z gồm H2SO4 2M và HCl 1M tạo ra m gam hh muối. Tính m
2Al+2H2O\(\rightarrow\)2AlOH+H2
Ba+2H2O\(\rightarrow\)Ba(OH)2+H2
nH2=0,08\(\rightarrow\)nOH=0,16
\(\text{nH2SO4=2V nHCl=V}\)
\(\rightarrow\)nH=2V.2+V=5V
2AlOH+H2SO4\(\rightarrow\)Al2SO4+2H2O
Ba(OH)2+H2SO4\(\rightarrow\)BaSO4+H2O
AlOH+HCl\(\rightarrow\)AlCl+H2O
Ba(OH)2+2HCl\(\rightarrow\)BaCl2+2H2O
Theo phương trình nH=nOH=0,16
\(\rightarrow\)5V=0,16\(\rightarrow\)V=0,032
\(\rightarrow\)\(\text{nH2SO4=0,064; nHCl=0,032}\)
\(\rightarrow\)\(\text{nSO4=0,064 nCl=0,032}\)
Ta có khối lượng muối=khối lương kim loại+ khối lượng SO4+khối lượng Cl
\(\rightarrow\)\(\text{m=3+0,064.96+0,032.35,5=10,28}\)
Cho 4,8 gam kim loại M vào 50 gam dung dịch HCl nồng độ 36,5 % , phản ứng xong thu được 4,48 lít khí H2 , ( ở đktc ) và dung dịch X. Xác định kim loại M và tính nồng độ phần trăm các chất trong X.
PTHH: \(2M+2xHCl\rightarrow2MCl_x+xH_2\uparrow\) (x là hóa trị của M)
Tính theo sản phẩm
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(\Rightarrow n_M=\dfrac{0,4}{x}\left(mol\right)\) \(\Rightarrow M=\dfrac{4,8}{\dfrac{0,4}{x}}=12x\)
Ta thấy với \(x=2\) thì \(M=24\) (Magie)
Mặt khác: \(n_{HCl}=\dfrac{50\cdot36,5\%}{36,5}=0,5\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{MgCl_2}=n_{H_2}=0,2\left(mol\right)\\n_{HCl\left(dư\right)}=0,1\left(mol\right)\end{matrix}\right.\)
Ta lại có: \(m_{dd\left(sau.p/ứ\right)}=m_{Mg}+m_{ddHCl}-m_{H_2}=4,8+50-0,2\cdot2=54,4\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{MgCl_2}=\dfrac{0,2\cdot95}{54,4}\cdot100\%\approx34,93\%\\C\%_{HCl\left(dư\right)}=\dfrac{0,1\cdot36,5}{54,4}\cdot100\%\approx6,71\%\end{matrix}\right.\)
Đúng 3
Bình luận (0)