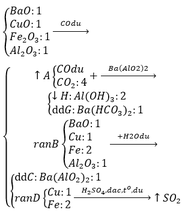
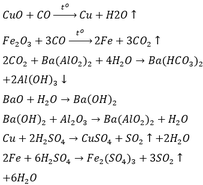1, Oxi hóa 4,5 g h/c A thu đc 9,9 g khí CO2 và 5,4g H2O. Xác định CTHH của h/c A. Biết PTK của A là 60.
2, Có hỗn hợp gồm 2,4 g Carbon và 9,3 g Photpho. Đem đót hoàn toàn hỗn hợp trên.
a, Tính thể tích Oxi cần dùng ở đktc ? Biết hiệu suất của quá trình đốt chỉ đạt 90 %.
b, Tính % k. lượng của các chất sau phản ứng .

















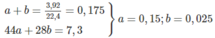
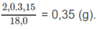

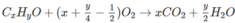
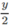 mol
H
2
O
mol
H
2
O
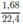 mol
C
O
2
và
mol
C
O
2
và 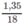 mol
mol 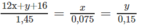
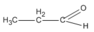 (propanal)
(propanal)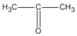 (propanon hay axeton)
(propanon hay axeton)