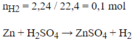Cho 10,5g hỗn hợp Cu, Zn tác dụng với H2SO4 loãng dư tạo thành 2,24l khí (đktc). tính % kim loại

Những câu hỏi liên quan
Cho 10,5g hỗn hợp 2 kim loại Cu và Zn vào dd H 2 S O 4 loãng dư, người ta thu được 2,24 lít khí (đktc). Hãy tính thành phần % theo khối lượng của Cu và Zn
: Cho 10,5g hỗn hợp 2 kim loại Cu và Zn vào dd H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Hãy tính thành phần % theo khối lượng của Cu và Zn .
Đọc tiếp
: Cho 10,5g hỗn hợp 2 kim loại Cu và Zn vào dd H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Hãy tính thành phần % theo khối lượng của Cu và Zn .
Cu ko phản ứng với H2SO4 loãng
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,1.65=6,5\left(g\right)\Rightarrow m_{Cu}=4\left(g\right)\)
\(\Rightarrow\%Zn=\dfrac{6,5}{10,5}=62\%;\%Cu=100\%-62\%=28\%\)
Đúng 1
Bình luận (0)
https://hoidap247.com/cau-hoi/1072966
Đúng 0
Bình luận (0)
Cho 10,5g hỗn hợp 2 kim loại Cu, Zn vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Tính khối lượng chất rắn còn lại sau phản ứng.
A. 3g
B. 4g
C. 5g
D. 6g
Z n + H 2 S O 4 → Z n S O 4 + H 2
Cu không tác dụng với axit Sunfuric.
⇒ n Z n = n H 2 = 2,24/22,4 = 0,1 mol
⇒ m Z n = 0,1.65 = 6,5g
⇒ m C u = m r a n c o n l a i = 10,5 - 6,5 =4g
⇒ Chọn B.
Đúng 0
Bình luận (0)
Cho 10,5g hỗn hợp hai kim loại cu và zn vào dung dịch H2SO4 loãng dư, người ta thu được 2,24l khí
a, viết PTHH
b, tính khối lượng chất rắn còn lại sau phản ứng
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ a,PTHH:Zn+H_2SO_4\to ZnSO_4+H_2\)
\(b,\) Vì Cu ko td \(H_2SO_4\) loãng nên chất rắn còn lại sau p/ứ bằng \(m_{Cu}\)
\(n_{Zn}=n_{H_2}=0,1(mol)\\ \Rightarrow m_{Zn}=0,1.65=6,5(g)\\ \Rightarrow m_{\text{rắn dư}}=m_{Cu}=10,5-6,5=4(g)\)
Đúng 1
Bình luận (2)
Cho 12,4 g hỗn hợp x gồm 2 kim loại cu và mg vào dung dịch H2SO4 loãng dư,thu được 5,6 lít khí(đktc) A)Tính khối lượng mỗi kim loại trong hỗn hợp x B)Cho hỗn hợp trên tác dụng với dung dịch AgNO3 dư tính khối lượng kim loại tạo thành Giải giúp ghi rõ a)b)c) để mình biết
Giúp mình
Bài 2 : Cho 10,5g hỗn hợp 2kim loại Cu,Zn vào dung dịch 500ml H2SO4 loãng dư,người ta thu được 2,24 lít khí (đktc).
a/ Viết phương trình hoá học.
b/Tính thành phần tram khối lượng mỗi kim loại trong hỗn hợp.
c/ Tính nồng độ mol dung dịch axit H2SO4.
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ a,Zn+H_2SO_4\to ZnSO_4+H_2\\ b,n_{Zn}=0,1(mol)\Rightarrow m_{Zn}=0,1.65=6,5(g)\\ \Rightarrow \%_{Zn}=\dfrac{6,5}{10,5}.100\%=61,9\%\\ \Rightarrow \%_{Cu}=100\%-61,9\%=38,1\%\\ c,n_{H_2SO_4}=0,1(mol)\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,1}{0,5}=0,2M\)
Đúng 1
Bình luận (3)
Cho 3,79g hỗn hợp hai kim loại là Zn và Al tác dụng với dung dịch H2SO4 loãng dư, thu được 1792 ml khí (đktc). Tính khối lượng từng kim loại trong hỗn hợp.
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\left(1\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\left(2\right)\)
Số mol khí H2 thu được:
\(n_{H_2}=\dfrac{1,792}{22,4}=0,08mol\)
Gọi a và b lần lượt là số mol Zn và Al trong hỗn hợp.
Từ ( 1 ) và ( 2 ) ta có:
\(\left\{{}\begin{matrix}a+\dfrac{3}{2}b=0,08\\65a+27b=3,79\end{matrix}\right.\rightarrow}\left\{{}\begin{matrix}a=0,05\\b=0,02\end{matrix}\right.\)
Khối lượng Zn: 65.0,05 = 3,25 g
Khối lượng Al: 27.0,02 = 0,54 gam
Đúng 1
Bình luận (0)
Cho 10,5g hỗn hợp 2 kim loại Cu; Zn vào dung dịch H2SO4 20%; người ta thu được 2,24l khí (đktc).
a. Viết PTHH.
b. Tính khối lượng chất rắn còn lại sau phản ứng.
c, Tính khối lượng dung dịch H2SO4 thu được sau phản ứng.
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
a. PTHH:
\(Zn+H_2SO_4--->ZnSO_4+H_2\)
\(Cu+H_2SO_4--\times-->\)
b. Theo PT: \(n_{Zn}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,1.65=6,5\left(g\right)\)
\(\Rightarrow m_{chất.rắn.còn.lại.sau.PỨ}=m_{Cu}=10,5-6,5=4\left(g\right)\)
c. Theo PT: \(n_{H_2SO_4}=n_{Zn}=0,1\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,1.98=9,8\left(g\right)\)
Ta có: \(C_{\%_{H_2SO_4}}=\dfrac{9,8}{m_{dd_{H_2SO_4}}}.100\%=20\%\)
\(\Leftrightarrow m_{dd_{H_2SO_4}}=49\left(g\right)\)
Đúng 4
Bình luận (0)
\(a,PTHH:Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ b,m_{\text{chất rắn sau p/ứ}}=m_{Cu}\\ n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ \Rightarrow n_{Zn}=0,1\left(mol\right)\\ \Rightarrow m_{Zn}=0,1\cdot65=6,5\left(g\right)\\ \Rightarrow m_{Cu}=10,5-6,5=4\left(g\right)\\ c,n_{H_2SO_4}=0,1\left(mol\right)\\ \Rightarrow m_{CT_{H_2SO_4}}=0,1\cdot98=9,8\left(g\right)\\ \Rightarrow m_{dd_{H_2SO_4}}=\dfrac{9,8\cdot100\%}{20\%}=49\left(g\right)\)
Đúng 0
Bình luận (0)
Bài 1: Cho 12 gam hỗn hợp X gồm Fe và Cu tác dụng với dung dịch H2SO4 loãng dư ,thu được 2,24lít khí H2 (đktc).Tính thành phần phần trăm mỗi kim loại trong hỗn hợp X.
Bài 2: Cho 13 gam kẽm tác dụng với axit clohidric, thu được V lít khí (đktc). Tính V?
Câu 1:
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ \Rightarrow n_{Fe}=0,1\left(mol\right)\\ \Rightarrow m_{Fe}=0,1\cdot56=5,6\left(g\right)\\ \Rightarrow\%_{Fe}=\dfrac{5,6}{12}\cdot100\%\approx46,67\%\\ \Rightarrow\%_{Cu}\approx100\%-46,67\%=53,33\%\)
Bài 2:
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ \Rightarrow n_{H_2}=n_{Zn}=0,2\left(mol\right)\\ \Rightarrow V=V_{H_2\left(đktc\right)}=0,2\cdot22,4=4,48\left(l\right)\)
Đúng 1
Bình luận (0)