



Hơi mờ nhưng vẫn nhìn đc , giúp em vs ạ

Ai giúp em với ạ!! NHưng hơi mờ ạ,mong mọi người giúp với :(
mình cũng muốn biết ai có thể làm được bài này ạ
có ai đó help tui vs có ai từ là cái này chưa tuy hơi mờ nhưng mk thấy vẫn đọc đc
BÀI THỰC HÀNH 3 HẢ mk cũng làm báo cáo nè cần giúp gì hông
Tên thí nghiệm | Mục đích thí nghiệm | Cách tiến hành | Hiện tượng | Nhận xét & Giải thích | Ghi chú |
| Thí nghiệm 1: Hòa tan và đun nóng kali pemanganat (thuốc tím ) | Nhận biết và phân biệt được hiện tương vật lí với hiện tượng hóa học | B1:Chia một lượng khoảng 0,5g thuốc tím lam 3 phần B2: Bỏ một phần vào ống nghiệm (1) (đựng nước), lắc cho tan bằng cách đập nhẹ vào lòng bàn tay B3:Bỏ 2 phàn còn lại vào ống nghiệm (2) rồi đun nóng. Đưa que đóm cháy dở còn tàn đỏ vào để thử, nếu que bùng cháy thì tiếp tục đun. Khi nào que đóm không còn cháy nữa thì ngừng đun, để nguội, rồi đổ nước vào lắc đều cho tan* | Ở ống nghiệm 1, thuốc tím hòa tan vào nước tạo thành dung dịch thuốc tím. Ở ống nghiệm 2, sau quá trình đun nóng, thuốc tím tạo thành 1 chất mới (chất kết tủa ) và không tan trong nước | Ở ống nghiệm 1, hiện tượng xảy ra là hiện tượng vật lí vì thuốc tím sau khi hòa vào nước vẫn giữ nguyên tính chất ban đầu. Ở ống nghiệm 2, hiện tượng xảy ra là hiện tượng hóa học vì thuốc tím sau quá trình đun nóng đã tạo thành chất mới là chất kết tủa và không còn giữ nguyên tính chất ban đầu (ở đây là không tan trong nước) | Hơ nóng ống nghiệm trước khi đun |
| Thí nghiệm 2: Thực hiện phản ứng với canxi đioxit | Nhận biết dấu hiệu có phản ứng hóa học xảy ra | a) dùng ống thuyer tinh thôi hơi thở lần lượt vào ống nghiệm 1 đựng nước và ống nghiệm 2 đựng nước vôi trong (canxi hidroxit) b) Đổ dung dịch natri cacbonat lần lợt vào ông nghiêm 1 và 2 Quan sát hiện tượng. | Ở ống nghiệm 1, sau 2 quá trình (a và b), đều không có hiện tượng gì xảy ra Ở ống nghiệm 2, sau quá trình a, nước vôi trong đục đi và sau quá trình b, thấy xuất hiện chất kết tủa màu trắng trên bề mặt.* | Giải thích hiện tượng ở ống nghiệm 2: chất cacbon đioxit phản ứng với canxi hidroxit tạo ra canxi cacbonat và nước, sau quá trình b, natri cacbonat phản ứng với canxi cacbonat và nước là canxi cacbonat và natri hidroxit** | Không thổi trực tiếp vào ống nghiệm |
*: Ngoài ra có thể biểu thị bằng hình minh họa
**:Viết thêm phương trình bằng chữ hoặc số ( nếu đã học rồi)
Thực ra cái bài thực hành này mk mới nộp sáng nay nên chỉ nhớ mang máng vậy thôi có gì bạn tự bổ sung nha!!! Cái này là viết dựa theo mẫu báo cáo của lớp mình<3<3
TKS !!! ![]()
![]()
![]()
Giúp e vs ạ, e đang cần gấp lắm. EM XIN LỖI VÌ HƠI MỜ Ạ, E XIN CẢM ƠN
 ảnh hơi mờ nhưg vẫn đọc đc mn giúp mik nhé mik cảm ơn.
ảnh hơi mờ nhưg vẫn đọc đc mn giúp mik nhé mik cảm ơn.
Giúp mình với bạn mình cần gấp ngay trong tối nay anh hơi mờ nhìn cố nha tạ ơn ạ

Bài 1:
a) Áp dụng tích chất dãy tỉ số bằng nhau:
\(\dfrac{x}{2}=\dfrac{y}{3}\)=\(\dfrac{x+y}{2+3}\)=\(\dfrac{-15}{5}\)= -3
=> x= -3.2= -6; y= -3.3= -9.
b) Áp dụng tích chất dãy tỉ số bằng nhau:
\(\dfrac{x}{3}=\dfrac{y}{4}\)=\(\dfrac{x-y}{3-4}\)=\(\dfrac{12}{-1}\)= -12
=> x= -12.3= -36; y= -12.4= -48
c) 3x=7y=\(\dfrac{x}{7}=\dfrac{y}{3}\)
Áp dụng tích chất dãy tỉ số bằng nhau:
\(\dfrac{x}{y}=\dfrac{y}{3}=\dfrac{x-y}{7-3}=\dfrac{-16}{4}=-4\)
=> x= -4.7= -28; y= -4.3= -12
d) \(\dfrac{x}{y}=\dfrac{17}{13}=\dfrac{x}{17}=\dfrac{y}{13}\)
Áp dụng tích chất dãy tỉ số bằng nhau:
\(\dfrac{x}{17}=\dfrac{y}{13}=\dfrac{x+y}{17+13}=\dfrac{-60}{30}=-2\)
=> x= -2.17= -34; y= -2.13= -26
e) Áp dụng tính chất dãy tỉ số bằng nhau:
\(\dfrac{x^2}{9}=\dfrac{y^2}{16}=\dfrac{x^2+y^2}{9+16}=\dfrac{100}{25}=4\)
=>x= 9= \(3^2\)= 3.4= 12; y= 16= \(4^2\)= 4.4= 16
Bài 2:
2x=3y=\(\dfrac{x}{3}=\dfrac{y}{2}\); 5y=7z=\(\dfrac{y}{7}=\dfrac{z}{5}\)
-> \(\dfrac{x}{3}=\dfrac{y}{2};\dfrac{y}{7}=\dfrac{z}{5}\) = \(\dfrac{x}{21}=\dfrac{y}{14};\dfrac{y}{14}=\dfrac{z}{10}\)=> \(\dfrac{x}{21}=\dfrac{y}{14}=\dfrac{z}{10}\) = \(\dfrac{3x}{63}=\dfrac{7y}{98}=\dfrac{5z}{50}\)
Áp dụng tích chất dãy tỉ số bằng nhau:
\(\dfrac{3x}{63}=\dfrac{7y}{98}=\dfrac{5z}{50}\)=\(\dfrac{3x-7y+5z}{63-98+50}\)=\(\dfrac{30}{15}=2\)
=> x= 2.21= 42
=> y= 2.14= 28
=> z= 2.10= 20
Hơi mờ nhưng cố giúp em nha m.n
Hơi mờ nhưng cố gắng giúp em nha m.n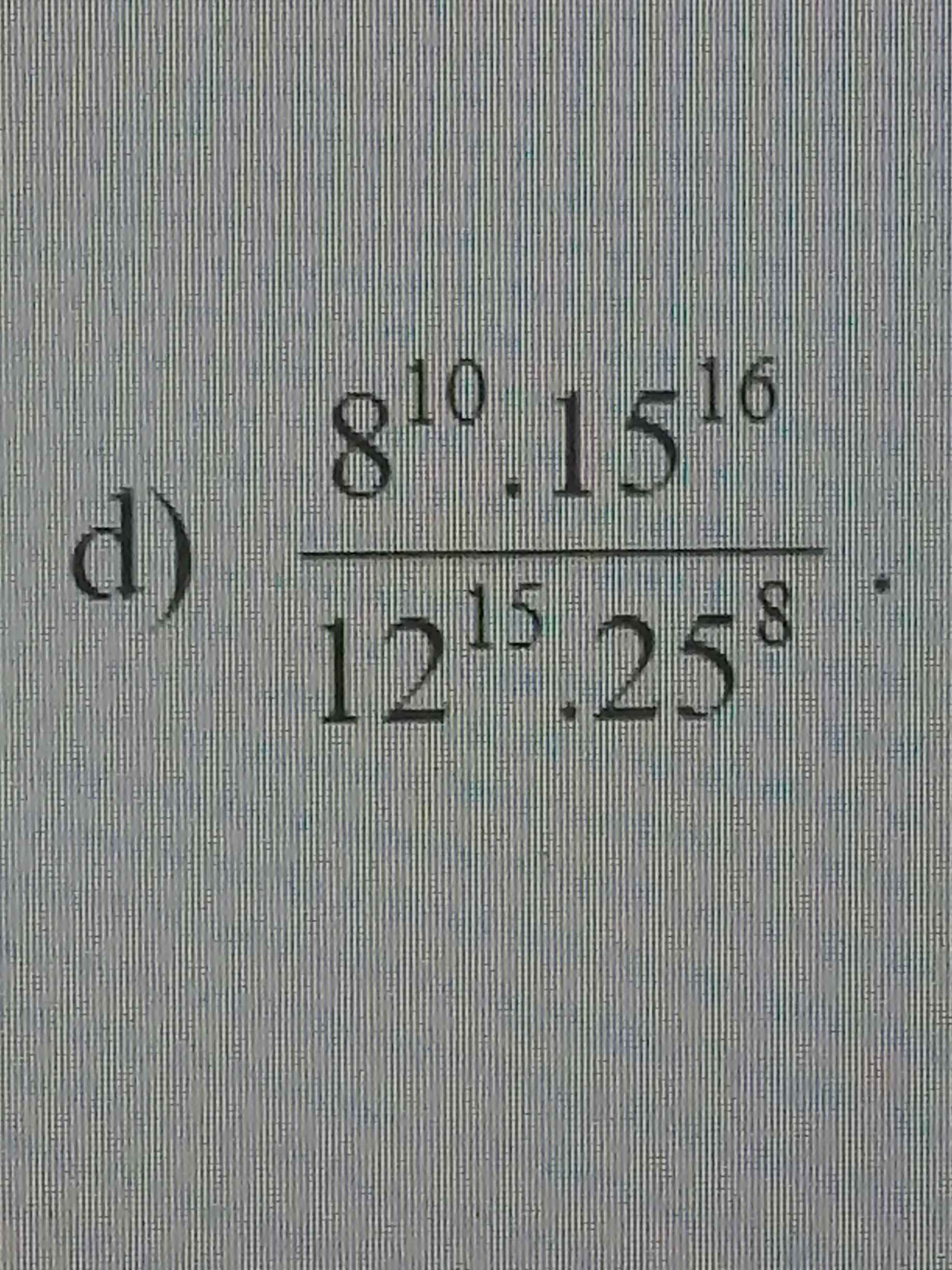
\(\dfrac{8^{10}.15^{16}}{12^{15}.25^8}\)
\(=\dfrac{\left(2.4\right)^{10}.\left(3.5\right)^{16}}{\left(3.4\right)^{15}.\left(5^2\right)^8}\)
\(=\dfrac{2^{10}.4^{10}.3^{16}.5^{16}}{3^{15}.4^{15}.5^{16}}\)
\(=\dfrac{2^{10}.3}{4^5}\)
\(=\dfrac{2^{10}.3}{2^{10}}=3\)
\(\dfrac{8^{10}.15^6}{12^{15}.25^8}\)
\(=\dfrac{\left(2.2.2\right)^{10}.\left(3.5\right)^{16}}{\left(3.2.2\right)^{15}.\left(5.5\right)^8}\)
\(=\dfrac{2^{10}.2^{10}.2^{10}.3^{16}.5^{16}}{3^{15}.2^{15}.2^{15}.5^8.5^8}\)
\(=\dfrac{3}{1}\)
\(=3\)
mọi người giúp em viết đề cương về Oxi với Hiđro với ạ
( Hơi lạc đề nhưng vẫn mong mọi người sẽ giúp ạ)
a) Dựa vào vị trí của các nguyên tố trong bảng tuần hoàn, hãy nêu rõ trong các nguyên tố sau đây những nguyên tố nào có cùng cộng hóa trị trong các oxit cao nhất:
Si, P, Cl, S, C,N, Se, Br.
b) Những nguyên tố nào sau đây có cùng cộng hóa trị trong các hợp chất khí với hidro
P, S, F, Si, Cl, N, As, Te.
Oxi :
Ôxy (bắt nguồn từ từ tiếng Pháp oxygène /ɔksiʒɛn/),[2] còn được viết là ô-xy,[2] ô-xi,[2] là nguyên tố hóa học có ký hiệu là O thuộc nhóm VI A và số hiệu nguyên tử bằng 8 trong bảng tuần hoàn các nguyên tố, nguyên tử khối bằng 16. Ôxy là nguyên tố phi kim hoạt động rất mạnh nó có thể tạo thành hợp chất oxit với hầu hết các nguyên tố khác[3]. Ở điều kiện nhiệt độ và áp suất tiêu chuẩn hai nguyên tử ôxy kết hợp với nhau tạo thành phân tử ôxy không màu, không mùi, không vị có công thức O2. Khí ôxy hóa lỏng ở nhiệt độ -183oC, màu xanh nhạt. Ôxy phân tử (O2, thường được gọi là ôxy tự do) trên Trái Đất là không ổn định về mặt nhiệt động lực học. Sự xuất hiện trong thời kỳ đầu tiên của nó trên Trái Đất là do các hoạt động quang hợp của vi khuẩn kỵ khí (vi khuẩn cổ và vi khuẩn). Sự phổ biến của nó từ sau đó đến ngày nay là do hoạt động quang hợp của cây xanh. Ôxy là nguyên tố phổ biến xếp hàng thứ 3 trong vũ trụ theo khối lượng sau hydro và heli[4] và là nguyên tố phổ biến nhất theo khối lượng trong vỏ Trái Đất.[5] Khí ôxy chiếm 20,9% về thể tích trong không khí.[6] Ôxy là nguyên tố hóa học phổ biến nhất (Chiếm 49,4% khối lượng vỏ Trái Đất)
Khí ôxy thường được gọi là dưỡng khí, vì nó duy trì sự sống của cơ thể con người.
Tất cả các nhóm phân tử cấu trúc chính trong các cơ thể sống như các protein, cacbohydrat, và mỡ chứa ôxy, cũng như trong các hợp chất vô cơ quan trọng cấu tạo tạo nên các vỏ sò, răng và xương. Ôxy ở dạng O2 được tạo ra từ nước bởi vi khuẩn lam, tảo và thực vật thông qua quá trình quang hợp và được sử dụng trong quá trình hô hấp của các cơ thể sống bậc cao. Ôxy là chất độc đối với các sinh vật kỵ khí bắt buộc, là các sinh vật thống trị trong thời buổi đầu trên Trái Đất cho đến khi O2 bắt đầu tích tụ trong khí quyển cách đây 2,5 tỷ năm.[7] Một dạng khác (thù hình) của ôxy là ôzôn (O3) tích tụ tạo thành lớp ôzon, khí này giúp bảo vệ sinh quyển khỏi tia tử ngoại, nhưng nó sẽ là chất ô nhiễm nếu nó nằm gần mặt đất ở dạng sương mù. Thậm chí ở quỹ đạo Trái Đất tầm thấp, nguyên tử ôxy cũng tồn tại và làm mòn các tàu không gian.[8]
Ôxy được Carl Wilhelm Scheele phát hiện ở Uppsala năm 1773 hoặc sớm hơn và Joseph Priestley ở Wiltshire năm 1774 độc lập nhau, nhưng Priestley thường được cho là phát hiện ra trước bởi vi ấn phẩm của ông được xuất bản trước. Tên gọi ôxy (oxygen) được Antoine Lavoisier đặt năm 1777,[9] các thí nghiệm của ông với ôxy đã giúp loại trừ thuyết phlogiston về sự cháy và ăn mòn phổ biến vào thời đó. Ôxy được sản xuất trong công nghiệp bằng cách chưng cất phân đoạn không khí lỏng, sử dụng zeolit để loại bỏ carbon dioxit và nitơ ra khỏi không khí, điện phân nước và các cách khác. Trong phòng thí nghiệm, người ta điều chế oxy bằng cách nhiệt phân một số chất giàu oxy như KMnO4, KClO3. Ôxy được sử dụng trong sản xuất công nghiệp (thép, nhựa và dệt); đốt nhiên liệu (nhiên liệu tên lửa); và hô hấp (hỗ trợ sự sống của con người trên tàu không gian, hay khi lặn dưới biển).
Hiđro :
Hiđro (bắt nguồn từ từ tiếng Pháp hydrogène /idʁɔʒɛn/),[8] còn được viết là hi-đrô,[8] cũng còn được gọi là hít-rô,[8] là một nguyên tố hóa học trong hệ thống tuần hoàn các nguyên tố với nguyên tử số bằng 1, nguyên tử khối bằng 1 đvC. Trước đây còn được gọi là khinh khí (như trong "bom khinh khí" tức bom H); hiện nay từ này ít được sử dụng. Sở dĩ được gọi là "khinh khí" là do hydro là nguyên tố nhẹ nhất và tồn tại ở thể khí, với trọng lượng nguyên tử 1,00794 u. Hydro là nguyên tố phổ biến nhất trong vũ trụ, tạo nên khoảng 75% tổng khối lượng vũ trụ và tới trên 90% tổng số nguyên tử. Các sao thuộc dải chính được cấu tạo chủ yếu bởi hydro ở trạng thái plasma. Hydro nguyên tố tồn tại tự nhiên trên Trái Đất tương đối hiếm do khí hydro nhẹ nên trường hấp dẫn của Trái Đất không đủ mạnh để giữ chúng khỏi thoát ra ngoài không gian, do đó hydro tồn tại chủ yếu dưới dạng hydro nguyên tử trong các tầng cao của khí quyển Trái Đất.
Đồng vị phổ biến nhất của hydro là proti, ký hiệu là H, với hạt nhân là một proton duy nhất và không có neutron. Ngoài ra hydro còn có một đồng vị bền là deuteri, ký hiệu là D, với hạt nhân chứa một proton và một neutron và một đồng vị phóng xạ là triti, ký hiệu là T, với hai neutron trong hạt nhân.
Với vỏ nguyên tử chỉ có một electron, nguyên tử hydro là nguyên tử đơn giản nhất được biết đến, và cũng vì vậy nguyên tử hydro tự do có một ý nghĩa to lớn về mặt lý thuyết. Chẳng hạn, vì nguyên tử hydro là nguyên tử trung hòa duy nhất mà phương trình Schrödinger có thể giải được chính xác nên việc nghiên cứu năng lượng và cấu trúc điện tử của nó đóng vai trò quan trọng trong sự phát triển của cả cơ học lượng tử và hóa học lượng tử.
Ở điều kiện thường, các nguyên tử hydro kết hợp với nhau tạo thành những phân tử gồm hai nguyên tử H2. (Ở những nhiệt độ cao, quá trình ngược lại xảy ra.) Khí hydro lần đầu tiên được điều chế một cách nhân tạo vào đầu thế kỷ XVI bằng cách nhúng kim loại vào trong một axit mạnh. Vào những năm 1766-1781, Henry Cavendish là người đầu tiên nhận ra rằng hydro là một chất riêng biệt và rằng khi bị đốt trong không khí nó tạo ra sản phẩm là nước. Tính chất này chính là nguồn gốc của tên gọi tiếng Pháp hydrogène (được tạo ra bằng cách ghép tiếp đầu ngữ tiếng Hy Lạp hydro-, có nghĩa là “nước”, với tiếp vĩ ngữ tiếng Pháp -gène, có nghĩa là “tạo ra”).[9] Ở điều kiện tiêu chuẩn, hydro là một chất khí lưỡng nguyên tử không màu, không mùi, không vị và là một phi kim.
Trong các hợp chất ion, hydro có thể có thể tồn tại ở hai dạng. Trong các hợp chất với kim loại, hydro tồn tại dưới dạng các anion hydrua mang một điện tích âm, ký hiệu H-. Hydro còn có thể tồn tại dưới dạng các cation H+ là ion dương sinh ra do nguyên tử hydro bị mất đi một electron duy nhất của nó. Tuy nhiên một ion dương với cấu tạo chỉ gồm một proton trần trụi (không có electron che chắn) không thể tồn tại được trong thực tế do tính dương điện hay tính axit và do đó khả năng phản ứng với các phân tử khác của H+ là rất cao. Một cation hydro thực sự chỉ tồn tại trong quá trình chuyển proton từ các axit sang các bazơ (phản ứng axit-bazơ). Trong dung dịch nước H+ (do chính nước hoặc một loại axit khác phân ly ra) kết hợp với phân tử nước tạo ra các cation hydroni H3O+, thường cũng được viết gọn là H+. Ion này đóng một vai trò đặc biệt quan trọng trong hóa học axit-bazơ.
Hydro tạo thành các hợp chất cộng hóa trị với hầu hết các nguyên tố khác. Nó có mặt trong nước và hầu hết các hợp chất hữu cơ cũng như các cơ thể sống.
Mk cx ko bt nx , mk hok ngu hóa lắm
Giúp tớ với!
Nhìn hơi mờ xíu
1B 2C 3A 4A 5C 6B 7D 8B 9D 10B 11B 12B 13D 14B 15B 16A 17C 18B 19A 20C