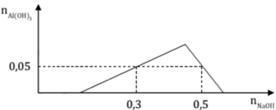
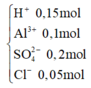
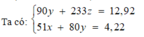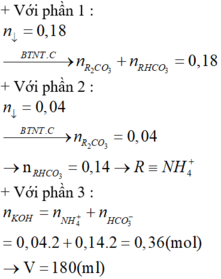các bạn giúp mình bài này nhé: dung dịch X tạo ra từ 2 muối với các ion:Al3+,Fe2+,SO42-,Cl-. chia dung dịch X thành 2 phần bằng nhau. phần 1 đem tác dụng với dd Ba(OH)2 dư thu được 6,46g kêt tủa. phần 2 đem tác dụng với dd NH3 dư, thu đươc kết tủa nung trong không khí đến khối lượng không đổi thu được hỗn hợp 2,11g chất rắn. các phản ứng xảy ra hoàn toàn. khối lượng muối trong dd X có thể là:
A.5,96g B. 3,475g C.17,5g D. 8,75g