Đốt một mẫu than đá (chứa tạp chất không cháy) có khối lượng 0,600kg trong oxi dư, thu được 1,06 m3 (đktc) khí cacbonic. Tính thành phần phần trăm khối lượng của cacbon trong mẫu than đá trên.

Những câu hỏi liên quan
Đốt một mẫu than đá (chứa tạp chất không cháy) có khối lượng 0,600kg trong oxi dư, thu được 1,06 m3 (đktc) khí cacbonic. Tính thành phần phần trăm khối lượng của cacbon trong mẫu than đá trên.
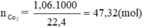
C + O2 → CO2
47,32 ← 47,32 (mol)
Theo pt: nC = nCO2 = 47,32 mol ⇒ mC = 47,32. 12 = 567,84 g
% khối lượng của C là:

Đúng 1
Bình luận (1)
Đốt một mẫu than (chứa tạp chất không cháy) có khối lượng 0,6 kg trong oxi dư thu được 1,06 m 3 (đktc) khí cacbonic. Thành phần phần trăm khối lượng cacbon trong mẫu than trên là
A. 94,64
B. 64,94
C. 49,64
D. 46,94
đốt một mẩu than đá (chứa hợp chất không cháy) có khối lượng 0,6 kg trong oxi dư , thu được 1,06m3 (điều kiện tiêu chuẩn) khí cacbonic . tính thành phần phần trăm khối lượng của cacbon trong mẫu than đá trên .
C + O2 => CO2
1,06m3 = 1060 (l) => nCO2 = \(\frac{1060}{22,4}=47,32mol\)
nC = nCO2 = 47,32 mol
=> mC = 47,32.12 = 567,84 (g)
m than đá = 0,6kg = 600g
=> % C = \(\frac{567,84}{600}.100\%\) = 94,64%
Đúng 0
Bình luận (0)
C + O2 CO2
1,00mol 1,00mol
47,3 mol = 47,3 (mol)
Phần trăm khối lượng của C trong mẫu than đá: = 94,6%
Đúng 0
Bình luận (0)
Đốt một mẫu than đá nặng 0,6 gam trong không khí (dư) thu được 1,06 lít khí cacbonic . Tính thành phần phần trăm theo khối lượng cacbon trong mẫu than đá trên.
C + O2 \(\xrightarrow[]{t^o}\) CO2
nCO2 = \(\dfrac{1,06}{22,4}\approx0,047mol\)
Theo pt: nC = nCO2 = 0,047 mol
=> mC = 0,047.12 = 0,564g
%mC = \(\dfrac{0,564}{0,6}.100\%=94\%44\)
Đúng 2
Bình luận (2)
$C + O_2 \xrightarrow{t^o} CO_2$
n C = n CO2 = 1,06/22,4 = 53/1120(mol)
m C = 53/1120 .12 = 0,568(gam)
Suy ra :
%C = 0,568/0,6 .100% =94,67%
Đúng 1
Bình luận (0)
Đốt một mẫu than đá (chứa tạp chất không cháy) có khối lượng 0,600kg trong oxi dư, thu được 1,06 m3 (đktc) khí cacbonic. Tính thành phần phần trăm khối lượng của cacbon trong mẫu than đá trên.
C + O2 →( t∘) CO2
1,00mol 1,00mol
47,3 mol \(\dfrac{1,06\cdot10^3}{22,4}\) = 47,3 (mol)
Phần trăm khối lượng của C trong mẫu than đá: \(\dfrac{47,3\cdot12,0\cdot100}{600}\) = 94,6%
Đúng 0
Bình luận (0)
đốt cháy 10 gam than đá trong oxi dư, thu được 16,8 lít khí cacbonic(đktc) và 560ml khí sunfurơ(đktc)
a, Tính độ tinh khiết của loại than đá trên(Biết rằng trong than đá cacbon là thành phần chính)
b, Tính thể tích khí oxi ở đktc đã dùng(Biết rằng oxi lấy dư 10%)
a)
\(n_{CO_2}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\)
PTHH: C + O2 --to--> CO2
0,75<-0,75<-----0,75
=> Độ tinh khiết = \(\%C=\dfrac{0,75.12}{10}.100\%=90\%\)
b)
\(n_{SO_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
PTHH: S + O2 --to--> SO2
0,025<-0,025<---0,025
=> \(V_{O_2\left(PTHH\right)}=\left(0,025+0,75\right).22,4=17,36\left(l\right)\)
=> \(V_{O_2\left(tt\right)}=\dfrac{17,36.110}{100}=19,096\left(l\right)\)
Đúng 2
Bình luận (0)
Nhiệt phân hoàn toàn 56,1g hỗn hợp gồm KClO3 và KMnO4 ở nhiệt đọ cao,sau phản ứng thu được 8,96 lít khí oxi ở đktc
a)tính thành phần phần trăm khối lượng mỗi chất có trong hỗn hợp đầu
b) Lượng oxi thu được ở trên đốt cháy được khối lượng than có hàm lượng cacbon chiếm 85% (còn lại là tạp chất không cháy)nhiều nhất và ít nhất là bao nhiêu ?
Đốt một mẫu than chì chứa tạp chất lưu huỳnh trong oxi. Cho hỗn hợp khí thoát ra tác dụng với lượng dư dung dịch brom, thấy có 0,32 g brom đã phản ứng. Cho khí thoát ra khỏi dung dịch brom tác dụng với lượng dư nước vôi trong, thu được 10,00 g kết tủa.1. Viết phương trình hoá học của các phản ứng xảy ra.2. Xác định phần trăm khối lượng của cacbon trong mẫu than chì.
Đọc tiếp
Đốt một mẫu than chì chứa tạp chất lưu huỳnh trong oxi. Cho hỗn hợp khí thoát ra tác dụng với lượng dư dung dịch brom, thấy có 0,32 g brom đã phản ứng. Cho khí thoát ra khỏi dung dịch brom tác dụng với lượng dư nước vôi trong, thu được 10,00 g kết tủa.
1. Viết phương trình hoá học của các phản ứng xảy ra.
2. Xác định phần trăm khối lượng của cacbon trong mẫu than chì.
Đốt hoàn toàn 120 gam than đá( lẫn tạp chất không cháy). sau phản ứng thu được 264 gam CO2. tìm tỉ lệ phần trăm khối lượng tạp chất trong than đá
PTHH: \(C+O_2\xrightarrow[]{t^o}CO_2\)
Tính theo sản phẩm
Ta có: \(n_C=n_{CO_2}=\dfrac{264}{44}=6\left(mol\right)\)
\(\Rightarrow\%m_C=\dfrac{12\cdot6}{120}\cdot100\%=60\%\) \(\Rightarrow\%_{tạp.chất}=40\%\)
Đúng 2
Bình luận (0)
\(n_{CO_2}=\frac{264}{44}=6(mol)\\ C+O_2\buildrel{{t^o}}\over\longrightarrow CO_2\\ n_{C}=n_{CO_2}=6(mol)\\ m_{C}=6.12=72(g)\\ \%m_{\text{tạp chât}}=\frac{120-72}{120}.100\%=40\%\)
Đúng 1
Bình luận (0)




























