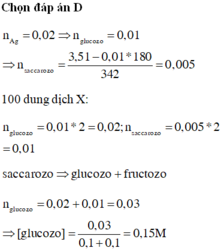Trong 400 ml dung dịch có chứa 19,6 gam H2SO4. Nồng độ mol của dung dịch thu được là ?

Những câu hỏi liên quan
Cho 400 gam dung dịch KOH 7% vào 100 gam dung dịch H2SO4 19,6%. Tính nồng độ % của các chất tan trong dung dịch thu được sau phản ứng.
\(n_{KOH}=\dfrac{400.7\%}{56}=0,5\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{100.19,6\%}{98}=0,2\left(mol\right)\)
PTHH: 2KOH + H2SO4 --> K2SO4 + 2H2O
Xét tỉ lệ: \(\dfrac{0,5}{2}>\dfrac{0,2}{1}\) => KOH dư, H2SO4 hết
PTHH: 2KOH + H2SO4 --> K2SO4 + 2H2O
0,4<----0,2-------->0,2
=> \(\left\{{}\begin{matrix}m_{KOH\left(dư\right)}=\left(0,5-0,4\right).56=5,6\left(g\right)\\m_{K_2SO_4}=0,2.174=34,8\left(g\right)\end{matrix}\right.\)
mdd sau pư = 400 + 100 = 500 (g)
=> \(\left\{{}\begin{matrix}C\%_{KOH.dư}=\dfrac{5,6}{500}.100\%=1,12\%\\C\%_{K_2SO_4}=\dfrac{34,8}{500}.100\%=6,96\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Cho 400 gam dung dịch KOH 7% vào 100 gam dung dịch H2SO4 19,6%. Tính nồng độ % của các chất tan trong dung dịch thu được sau phản ứng
\(n_{KOH}=\dfrac{400.7}{100}:56=0,5\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{100.19,6}{100}:98=0,2\left(mol\right)\)
\(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
0,4 0,2 0,2
Lập tỉ lệ:
\(\dfrac{0,5}{2}>\dfrac{0,2}{1}\) => KOH dư.
\(m_{dd}=400+100=500\left(g\right)\)
\(n_{KOH.dư}=0,5-0,4=0,1\left(mol\right)\)
\(C\%_{K_2SO_4}=\dfrac{0,2.174.100}{500}=6,96\%\)
\(C\%_{KOH}=\dfrac{0,1.56.100}{500}=1,12\%\)
Đúng 1
Bình luận (0)
Dung dịch X chứa Fe2(SO4)3 và MgSO4.
- Cho dung dịch BaCl2 dư vào 400 ml dung dịch X thu được 93,2 gam kết tủa trắng.
- Cho dung dịch NaOH dư vào 400 ml dung dịch X thu được 27,2 gam kết tủa trắng.
Xác định nồng độ mol/l mỗi chất có trong dung dịch X.
Gọi số mol Fe2(SO4)3 và MgSO4 trong 400ml dd X là a, b
TN1:
PTHH: Fe2(SO4)3 + 3BaCl2 --> 3BaSO4 + 2FeCl3
________a------------------------->3a
MgSO4 + BaCl2 --> MgCl2 + BaSO4
__b---------------------------->b
=> 3a + b = \(\dfrac{93,2}{233}=0,4\)
TN2:
PTHH: 6NaOH + Fe2(SO4)3 --> 2Fe(OH)3 + 3Na2SO4
a------------->2a
MgSO4 + 2NaOH --> Mg(OH)2 + Na2SO4
__b--------------------->b
=> 107.2a + 58b = 27,2
=> a =0,1 ; b = 0,1
=> \(\left\{{}\begin{matrix}C_{M\left(Fe_2\left(SO_4\right)_3\right)}=\dfrac{0,1}{0,4}=0,25M\\C_{M\left(MgSO_4\right)}=\dfrac{0,1}{0,4}=0,25M\end{matrix}\right.\)
Đúng 1
Bình luận (0)
tk
Gọi số mol MgSO4 và Al2(SO4)3 lần lượt là x và y (mol) có trong 200ml dung dịch.
+ 400 ml dd X + NH3 dư => kết tủa thu được là Mg(OH)2 : 2x ( mol) và Al(OH)3: 4y (mol)
=> ∑ mkết tủa = 58.2x + 78.4y = 65,36 (1)
+ 200 ml dd X + Ba(OH)2 dư => kết tủa thu được là Mg(OH)2 : x (mol) và BaSO4 : x + 3y (mol) ( Vì Al(OH)3 tan được trong dd Ba(OH)2 dư)
=> ∑ mkết tủa = 58x + (x + 3y).233 = 151,41 (2)
Từ (1) và (2) => x = 0,16 ; y = 0,15
+ 500 ml dd X ( có 0,4 mol Mg2+, 0,75 mol Al3+) + NaOH→ 70gam kết tủa => lượng NaOH lớn nhất ứng với trường hợp tạo Mg(OH)2↓ và Al(OH)3↓ sau đó kết tủa bị hòa tan 1 phần
=> nAl(OH)3 = (70 – 0,4.58)/78 = 0,6 (mol)
Mg2+ + 2OH → 2Mg(OH)2↓
0,4 → 0,8 (mol)
Al3+ + 3OH-→ Al(OH)3↓
0,75→2,25 → 0,75 (mol)
Al(OH)3+ OH- → AlO2- + 2H2O
(0,75-0,6) → 0,15 (mol)
∑ nOH-= 0,8 + 2,25 + 0,15 = 3,2 (mol) =nNaOH
=> mNaOH = 3,2.40 = 128 (g)
Đúng 0
Bình luận (0)
Cho 50 ml dung dịch X chứa 3,51 gam hỗn hợp saccarozơ và glucozơ phản ứng với lượng dư
A
g
N
O
3
trong dung dịch
N
H
3
, thu được 2,16 gam
A
g
. Đun nóng 100 ml dung dịch X với 100 ml dung dịch
H
2
S
O
4
0,05M cho đến khi phản ứng hoàn toàn thu được dung dịch Y, giả...
Đọc tiếp
Cho 50 ml dung dịch X chứa 3,51 gam hỗn hợp saccarozơ và glucozơ phản ứng với lượng dư A g N O 3 trong dung dịch N H 3 , thu được 2,16 gam A g . Đun nóng 100 ml dung dịch X với 100 ml dung dịch H 2 S O 4 0,05M cho đến khi phản ứng hoàn toàn thu được dung dịch Y, giả thiết thể tích dung dịch không thay đổi. Nồng độ mol của glucozơ có trong dung dịch Y là ?
A. 0,10M
B. 0,25M
C. 0,20M
D. 0,15M
Cho m gam metylamin tác dụng vừa đủ với 300 ml dung dịch
H
2
S
O
4
1M thu được dung dịch chứa 2 muối có cùng nồng độ mol. Giá trị của m là: A. 18,20 B. 9,30 C. 13,95 D. 4,65
Đọc tiếp
Cho m gam metylamin tác dụng vừa đủ với 300 ml dung dịch H 2 S O 4 1M thu được dung dịch chứa 2 muối có cùng nồng độ mol. Giá trị của m là:
A. 18,20
B. 9,30
C. 13,95
D. 4,65
Khi cho 100 ml dung dịch KOH 1M vào 100 ml dung dịch HCl thu được dung dịch có chứa 6,525 gam chất tan. Nồng độ mol của HCl trong dung dịch đã dùng là
A. 0,75M.
B. 1M.
C. 0,25M.
D. 0,5M
Hoà tan hoàn toàn m gam Fe trong 200 ml dung dịch
H
2
SO
4
loãng (dư), thu được dung dịch X và 2,24 lít khí
H
2
(đktc). Thêm 100 ml dung dịch
Ba
OH
2
1M vào X, thu được 28,7 gam kết tủa. Nồng độ mol của dung dịch
H
2
SO
4
ban đầu là...
Đọc tiếp
Hoà tan hoàn toàn m gam Fe trong 200 ml dung dịch H 2 SO 4 loãng (dư), thu được dung dịch X và 2,24 lít khí H 2 (đktc). Thêm 100 ml dung dịch Ba OH 2 1M vào X, thu được 28,7 gam kết tủa. Nồng độ mol của dung dịch H 2 SO 4 ban đầu là
A. 0,7M
B. 1,4M
C. 0,8M
D. 1,0M
Trộn 100 ml dung dịch H2SO4 2M với 400 ml dung dịch H2SO4 1M thu được dung dịch X. Tính nồng độ mol/l của dung dịch X bằng nhiều cách
$V_{dd\ sau\ pư} = 100 + 400 = 500(ml) = 0,5(lít)$
$n_{H_2SO_4} = 0,1.2 + 0,4.1 = 0,6(mol)$
$C_{M_{H_2SO_4}} = \dfrac{n}{V} = \dfrac{0,6}{0,5} = 1,2M$
Đúng 0
Bình luận (0)
Rót 400 gam dung dịch BaCl2 5,2% vào 100 ml dung dịch H2SO4 19,6 (D = 1,14 g/mol)
a, Tính khối lượng kết tủa tạo thành
b. Tính nồng đọ % của các chất trong dung dịch thu được sau khi lọc bỏ kết tủa
\(n_{BaCl_2}=\frac{400.5,2\%}{208}=0,1\left(mol\right);n_{H_2SO_4}=\frac{100.1,14.19,6\%}{98}=0,228\left(mol\right)\)
PTHH: \(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
Theo đề: 0,1.........0,228.....................................(mol)
Lập tỉ lệ: \(\frac{0,1}{1}< \frac{0,228}{1}\)=> Sau phản ứng H2SO4 dư
Theo PT: \(n_{BaSO_4}=n_{BaCl_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{BaSO_4}=0,1.233=23,3\left(g\right)\)
dd sau khi lọc bỏ kết tủa: H2SO4 dư, HCl
\(m_{ddsaup.ứ}=400+114-23,3=490,7\left(g\right)\)
\(\Rightarrow C\%_{H_2SO_4\left(dư\right)}=\frac{\left(0,228-0,1\right).98}{490,7}.100=2,56\%\)
\(C\%_{HCl}=\frac{0,1.2.36,5}{490,7}.100=1,49\%\)
Đúng 0
Bình luận (0)