cái chỗ muối cacbonat hoá trị II đó các bạn hiểu là kim loại trong muối đó có hoá trị II nhé 

Những câu hỏi liên quan
Hoà tan hết hỗn hợp X gồm oxit của một kim loại có hoá trị II và muối cacbonat của kim loại đó bằng H2SO4 loãng vừa đủ, sau phản ứng thu được sản phẩm gồm khí Y và dung dịch Z. Biết lượng khí Y bằng 44% lượng X. Đem cô cạn dung dịch Z thu được một lượng muối khan bằng 168% lượng X. Hỏi kim loại hoá trị II nói trên là kim loại gì? Tính thành phần phần trăm của mỗi chất trong hỗn hợp X.
Đọc tiếp
Hoà tan hết hỗn hợp X gồm oxit của một kim loại có hoá trị II và muối cacbonat của kim loại đó bằng H2SO4 loãng vừa đủ, sau phản ứng thu được sản phẩm gồm khí Y và dung dịch Z. Biết lượng khí Y bằng 44% lượng X. Đem cô cạn dung dịch Z thu được một lượng muối khan bằng 168% lượng X. Hỏi kim loại hoá trị II nói trên là kim loại gì? Tính thành phần phần trăm của mỗi chất trong hỗn hợp X.
RO+H2SO4→ RSO4+H2O (1)
RCO3+H2SO4→ RSO4+CO2+H2O (2)
Đặt a là khối lượng hỗn hợp X.
x,y là số mol RO và RCO3
Ta có : (R+16)x+(R+60)y=a (*)
Từ (1) và (2) \Rightarrow (R+96)(x+y)=1,68a (**)
Từ (2) \Rightarrow y=0,01a (***)
Giải (*),(**) và (***) \Rightarrow x=0,004a : R=24
Vậy R là Mg
Đúng 0
Bình luận (2)
Hoà tan hoàn toàn 3,34 gam hỗn hợp hai muối cacbonat kim loại hoá trị II và hoá trị III bằng dung dịch HCL dư ta thu được dung dịch A và 0,896 lít khí bay ra (đktc).Khối lượng muối có trong dung dịch A là
\(n_{CO_2}=\dfrac{0.896}{22.4}=0.04\left(mol\right)\)
\(\Rightarrow n_{HCl}=0.04\cdot2=0.08\left(mol\right)\Rightarrow m_{HCl}=0.08\cdot36.5=2.92\left(g\right)\)
\(\Rightarrow n_{H_2O}=0.04\left(mol\right)\Rightarrow m_{H_2O}=0.04\cdot18=0.72\left(g\right)\)
\(BTKL:\)
\(m_{Muối}=3.34+2.92-0.04\cdot44-0.72=3.78\left(g\right)\)
Đúng 3
Bình luận (0)
Câu 2: Hỗn hợp A gồm oxit của một kim loại hoá trị II và muối cacbonat của kim loại đó được hoà tan hết bằng axit HCl vừa đủ tạo ra khí B và còn dung dịch D. Đem cô cạn D thu được một lượng muối khan bằng 168,4% lượng A. Biết khối lượng khí B bằng 44,6% lượng A. Hỏi kim loại hoá trị II nói trên là nguyên tố nào ? % lượng mỗi chất trong A bằng bao nhiêu.
Đọc tiếp
Câu 2: Hỗn hợp A gồm oxit của một kim loại hoá trị II và muối cacbonat của kim loại đó được hoà tan hết bằng axit HCl vừa đủ tạo ra khí B và còn dung dịch D. Đem cô cạn D thu được một lượng muối khan bằng 168,4% lượng A. Biết khối lượng khí B bằng 44,6% lượng A. Hỏi kim loại hoá trị II nói trên là nguyên tố nào ? % lượng mỗi chất trong A bằng bao nhiêu.
Bài này tương tự, tham khảo.
Hỗn hợp A gồm oxit của một kim loại hoá trị II và muối cacbonat của kim loại đó được hoà tan hết bằng axit HCl vừa đủ tạo ra khí B và còn dung dịch D. Đem cô cạn D thu được một lượng muối khan bằng 168% lượng A. Biết khối lượng khí B bằng 44% lượng A. Hỏi kim loại hoá trị II nói trên là nguyên tố nào ? % lượng mỗi chất trong A bằng bao nhiêu.
Bài làm
Gọi kim loại hóa trị II là R, có nguyên tử khối là R (R > 0), x là số mol của RO (x > 0)
Theo bài ra ta có các PTHH :
RO + H2SO4 \(\rightarrow\) RSO4 + H2O
RCO3 + H2SO4 \(\rightarrow\) RSO4 + CO2\(\uparrow\) + H2O
Giả sử khối lượng của A đem tham gia p.ứng là 100g thì khối lượng RSO4 = 168g và khối lượng CO2 = 44g \(\approx\) 1 mol.
Theo giả sử ta có : (R + 16)x + R + 60 = 100 (1)
Theo phương trình ta có : (R + 96)x + R + 96 = 168 (2)
Từ (1), (2) \(\Rightarrow\) x = 0,4
R \(\approx\) 24 \(\Rightarrow\) Mg
Phần trăm khối lượng của oxit là : %MgO = 16%
Phần trăm khối lượng của muối là : %MgCO3 = 84%
Đúng 1
Bình luận (3)
Hoà tan hoàn toàn 10,05 gam hỗn hợp 2 muối cacbonat kim loại hoá trị II vào dung dịch HCl thu được dung dịch A và 0,672 lít khí (đktc). Khối lượng muối trong A là
A. 10,38gam
B. 20,66gam
C. 30,99gam
D. 9,32gam
Đáp án A
![]() = 0,03 (mol)
= 0,03 (mol)
MCO3 + 2HCl → MCl2 + H2O + CO2
0,06 ← 0,03 0,03
Bảo toàn khối lượng
mmuối + mHCl = mmuối (A) + mCO2 + mH2O
10,05 + 0,06.36,5 = mmuối (A) + 0,03.44 + 0,03.18 => m = 10,38 (g)
Đúng 0
Bình luận (0)
Câu 16. Thêm dung dịch NaOH dư vào dung dịch chứa 16 gam muối sunfat của một kim loại hoá trị II rồi lọckết tủa tách ra đem nung nóng thu được 8 gam oxit của kim loại hoá trị II đó. Công thức muối sunfat là:A. MgSO4 B. ZnSO4 C. CuSO4 D. FeSO4Câu 17. Chất tác dụng với nước tạo ra dung dịch bazơ là:A. CO2. B. Na2O. C. SO2. D. P2O5Câu 18. Chất tác dụng với nước tạo ra dung dịch axit làA. K2O. B. CuO. C. P2O5. D. CaO.Câu 19. Dãy các bazơ bị nhiệt phân huỷ tạo thành oxit bazơ tương ứng và nước:A. Cu(...
Đọc tiếp
Câu 16. Thêm dung dịch NaOH dư vào dung dịch chứa 16 gam muối sunfat của một kim loại hoá trị II rồi lọc
kết tủa tách ra đem nung nóng thu được 8 gam oxit của kim loại hoá trị II đó. Công thức muối sunfat là:
A. MgSO4 B. ZnSO4 C. CuSO4 D. FeSO4
Câu 17. Chất tác dụng với nước tạo ra dung dịch bazơ là:
A. CO2. B. Na2O. C. SO2. D. P2O5
Câu 18. Chất tác dụng với nước tạo ra dung dịch axit là
A. K2O. B. CuO. C. P2O5. D. CaO.
Câu 19. Dãy các bazơ bị nhiệt phân huỷ tạo thành oxit bazơ tương ứng và nước:
A. Cu(OH)2 ; Zn(OH)2; Al(OH)3; Mg(OH)2.
B. Cu(OH)2 ; Zn(OH)2; Al(OH)3; NaOH.
C. Fe(OH)3; Cu(OH)2; KOH; Mg(OH)2.
D. Fe(OH)3; Cu(OH)2; Ba(OH)2; Mg(OH)2.
Câu 20. Trung hòa 200 ml dung dịch NaOH 1M bằng dung dịch H2SO4 10%. Khối lượng dung dịch H2SO4 cần
dùng là
A. 9,8 g B. 89 g C. 98 g D.8,9 g
Câu 21. Khi phân hủy bằng nhiệt 28,4 g hỗn hợp CaCO3 và MgCO3 ta thu được 6,72 lít CO2 ở đktc. Thành phần
phần trăm về khối lượng các chất trong hỗn hợp đầu là:
A. 29,58% và 70,42%. B. 65% và 35%.
C. 70,42% và 29,58%. D. 35% và 65%.
Câu 22. Cho các oxit: Fe2O3; Al2O3; SO2; P2O5; CO; CaO; SiO2 các oxit phản ứng với nước ở nhiệt độ thường:
A. Fe2O3; SO2; P2O5 B. Al2O3; CaO; SiO2
C. SO2; P2O5; CaO D. SO2; CO; CaO
Câu 23. Khí X có đặc điểm: Là một oxit axit và nhẹ hơn khí NO2 . Khí X là
A. CO2 B. Cl2 C. HCl D. SO2
Câu 24. Các bazơ không tan là
A. NaOH, Mg(OH)2, Fe(OH)3, Fe2O3. B. Mg(OH)2, Fe(OH)3, H3PO4.
C. NaOH, Mg(OH)2, Fe(OH)3. D. Mg(OH)2, Fe(OH)3.
Câu 25. Trong các chất sau đây, chất làm quỳ tím chuyển màu xanh là
A. H2O B. dung dịch H2SO4
C. dung dịch KOH D. dung dịch Na2SO4
Câu 26. Nhỏ dung dịch FeSO4 vào dung dịch NaOH người ta thu được hiện tượng nào sau đây?
A. Chất khí không màu bay ra B. Kết tủa đỏ nâu
C. Kết tủa trắng D. Kết tủa trắng xanh
Câu 27. Chất X có các tính chất:
− Tan trong nước tạo dung dịch X.
− Dung dịch X phản ứng được với dung dịch Na2SO4.
− Làm phenolphtalein chuyển sang màu hồng.
X là
A. KCl B. KOH C. Ba(OH)2 D. BaCl2
Câu 28. Ngâm đinh sắt trong dung dịch đồng II sunfat (CuSO4). Hiện tượng gì xảy ra.
A. Không xuất hiện tượng.
B. Xuất hiện đồng màu đỏ bám trên đinh, đinh Fe không bị tan.
C. Xuất hiện đồng màu đỏ bám trên đinh, đinh Fe bị tan 1 phần, màu xanh của dd nhạt dần.
D. Không có Cu bám trên đinh Fe, chỉ 1 phần đinh bị tan.
16. C
17. B
18. C
19. A
20. C
21. C
22. C
23. A
24. D
25. C
26. C (hoặc D trong điều kiện có không khí)
27. C
28. C
Đúng 1
Bình luận (0)
Trong một cái cốc đựng một muối cacbonat của kim I loại hoá trị. Thêm từ từ dung dịch H2SO4 10% vào cốc cho đến khi khí vừa thoát ra hết thu được dung dịch muối sunfat nồng độ 13,63%. Kim loại hoá trị I là A. Li. B. Na. C. K. D. Ag.
Đọc tiếp
Trong một cái cốc đựng một muối cacbonat của kim I loại hoá trị. Thêm từ từ dung dịch H2SO4 10% vào cốc cho đến khi khí vừa thoát ra hết thu được dung dịch muối sunfat nồng độ 13,63%. Kim loại hoá trị I là
A. Li.
B. Na.
C. K.
D. Ag.
Đáp án B
Giả sử

khối lượng dung dịch sau phản ứng:
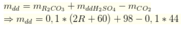
![]()
![]()
Đúng 0
Bình luận (0)
Hoà tan một kim loại hoá trị II trong một lượng vừa đủ dung dịch H2SO4 20% thì thu được dung dịch muối có nồng độ 22,6%. Xác định kim loại đó.
Tham khảo
Gọi m_ddH2SO4 = 294 gam → nH2SO4 =0,6 mol
R2O3 + 3H2SO4 → R2(SO4)3 +3H2O
0,2 0,6 0,2 0,6
=> m = 294 + 9,6 + 0,4R
=> 0,2(2R + 96.3)/303,6 + 0,4R = 0,21756
=> R = 27 => R = AI
Đúng 0
Bình luận (1)
Hoà tan hoàn toàn 4g hỗn hợp gồm 1 kim loại hoá trị II và một kim loại hoá trị III cần dùng hết 170 ml HCl 2M.
a) Cô cạn dung dịch thu được bao nhiêu gam muối?
b) Vính V H2 thoá ra ở dktc
c) Nếu biết kim loại hoá trị III là Al và số mol bằng 5 lần số mol kim loại hoá trị II thì kim loại hoá trị II là kim loại nào?
Gọi hai kim loại cần tìm lần lượt là A(II) và B(III)
Gọi a,b lần lượt là số mol A, B
Đổi 170ml = 0,17l
A + 2HCl = ACl2 + H2 (1)
a 2a a a (mol)
2B + 6HCl = 2BCl3 + 3H2 (2)
b 3b b 1,5b (mol)
Số mol HCl là : 0,17 x 2= 0,34(mol) = 2a + 3b (mol)
Khối lượng HCl là: 0,34 x 36,5 = 12,41 (g)
Theo PTHH (1)(2): n H2 = a+1,5b= 1/2 nHCl= 0,34:2= 0,17 (mol)
Khối lượng H2 thu đc là: 0,17 x 2= 0,34(g)
Theo ĐL bảo toàn khối lượng:
mhh + m HCl = mMuối + m H2
=> m muối= 4 + 12,41 - 0,34 = 16,07(g)
b, Thể tích H2 thoát ra là: 0,17 x 22,4 = 3,808 (l)
c, Ta có: b= 5a
A + 2HCl = ACl2 + H2
a a (mol)
2Al + 6HCl = 2AlCl3 + 3H2
5a 7,5a (mol)
Số mol H2 thu được là: a+ 7,5a= 8,5a= 0,17(mol)
=> a= 0,02 (mol)
Ta có phương trình:
MA x a + 27 x 5a = 4 (g)
=> a ( MA + 135) =4 (g)
=> MA + 135 = 4/ 0,02= 200(g)
=> MA = 200 - 135= 65(g)
Vậy A là kim loại Zn
Đúng 1
Bình luận (7)
Cho 4,2g muối cacbonat của kim loại hoá trị II. Hoà tan vào dung dịch HCl dư, thì có khí thoát ra. Toàn bộ lượng khí được hấp thụ vào 100ml dung dịch Ba(OH)2 0,46M thu được 8,274g kết tủa. Kim loại là A. Ca hoặc Mg B. Ca C. Mg D. Ba hoặc Ca
Đọc tiếp
Cho 4,2g muối cacbonat của kim loại hoá trị II. Hoà tan vào dung dịch HCl dư, thì có khí thoát ra. Toàn bộ lượng khí được hấp thụ vào 100ml dung dịch Ba(OH)2 0,46M thu được 8,274g kết tủa. Kim loại là
A. Ca hoặc Mg
B. Ca
C. Mg
D. Ba hoặc Ca
Đáp án A
Vì chưa biết lương Ba(OH)2 dư hay thiếu => có 2 trường hợp
* TH1: khi Ba(OH)2 dư, tính theo lượng kết tủa
Gọi công thức muối là MCO3
CO2 + Ba(OH)2 → BaCO3 + H2O
0,042 0,042
MCO3 +2 HCl → MCl2 + CO2 + H2O
0,042 0,042
Mmuối = M+ 60 = 4,2/0,042=100 => M = 40 (Ca)
* TH2: khi Ba(OH)2 thiếu , Ba(OH)2 hết, 1 phẩn kết tủa bị hòa tan
CO2 + Ba(OH)2 → BaCO3 + H2O
0,046 0,046
nkết tủa bị hòa tan = 0,046- 0,042=0,004
BaCO3 + CO2 + H2O → Ba(HCO3)2
0,004 0,004
=> nCO2 = 0,004+ 0,0046=0,05
MCO3 +2 HCl → MCl2 + CO2 + H2O
0,05 0,05
Mmuối = M+ 60 = 4,2/0,05 = 84 => M = 24 (Mg)
Chú ý: Xét 2 trường hợp
Đúng 0
Bình luận (0)


















