pH của dung dịch nào sau đây có giá trị nhỏ nhất?
A. Dung dịch HCl 0,1 M.
B. Dung dịch CH3COOH 0,1 M.
C. Dung dịch NaCl 0,1 M.
D. Dung dịch NaOH 0,01 M.
pH của dung dịch nào sau đây có giá trị nhỏ nhất
a, Dung dịch HNO3 0,1 M
b, Dung dịch HF 0,1M
c, Dung dịch KCL 0,1 M
d, Dung dịch KOH 0,01M
\(a,pH=-log\left[H^+\right]=1\\ b,pH=-log\left[H^+\right]=-log\left[0,1\right]=1\\ c,pH=7\\ d,pH=14-\left(-log\left[OH^-\right]\right)=14-\left(log\left[0,01\right]\right)=12\)
Chọn A và B
Đáp án: A
a, pH = -log[H+] = 1 (HNO3 là axit mạnh nên phân li hoàn toàn)
b, HF là axit yếu, phân ly không hoàn toàn ⇒ [H+] < 0,1 ⇒ pH > 1
c, KCl là muối trung hòa ⇒ pH = 7
d, KOH là bazo mạnh, phân ly hoàn toàn ⇒ pH = 14 - (-log[0,01]) = 12
Trong các dung dịch có cùng nồng độ 0,1 M sau đây, dung dịch nào có giá trị pH nhỏ nhất?
A. KOH.
B. H2SO4.
C. HCl.
D. Ba(OH)2.
Hấp thụ hết 0,1 mol CO2 vào dung dịch có chứa 0,08 mol NaOh và 0,1 mol Na2CO3, thu được dung dịch X. Nhỏ từ từ dung dịch HCl vào dung dịch X đến khi thoát ra 0,08 mol khí CO2 thì thấy hết x mol HCl. Giá trị của x là:
A. 0,16.
B. 0,15.
C. 0,18.
D. 0,17.
Hấp thụ hết 0,1 mol CO2 vào dung dịch có chứa 0,08 mol NaOH và 0,1 mol Na2CO3, thu được dung dịch X. Nhỏ từ từ dung dịch HCl vào dung dịch X đến khi thoát ra 0,08 mol khí CO2 thì thấy hết
x mol HCl. Giá trị của x là:
A. 0,16
B. 0,15
C. 0,18
D. 0,17
Cho dung dịch X chứa đồng thời AlCl3 0,1 M và Al2(SO4)3 0,1 M. Nhỏ từ từ đến hết V1 ml dung dịch NaOH 1,0 M vào 100 ml dung dịch X, sau đó thêm từ từ V2 ml dung dịch HCl a M vào hệ. Gọi V (ml) là tổng thể tích dung dịch NaOH và dung dịch HCl được thêm vào ở trên. Khối lượng kết tủa trong hệ phụ thuộc vào giá trị V được biểu diễn như đồ thị bên dưới.
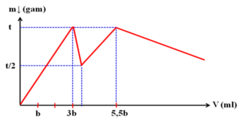
Giá trị tối thiểu của V để lượng kết tủa bị hòa tan hết là
A. 165,0.
B. 525,0.
C. 360,0.
D. 420,0.
Chọn B.
Tại V = 3b (kết tủa đạt cực đại) Þ 
Kết tủa bị hoà tan hết thì dung dịch thu được là Al3+ (0,03), Na+ (0,105), Cl- (y + 0,03) và SO42- (0,03)
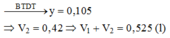
Cho dung dịch X chứa đồng thời AlCl3 0,1 M và Al2(SO4)3 0,1 M. Nhỏ từ từ đến hết V1 ml dung dịch NaOH 1,0 M vào 100 ml dung dịch X, sau đó thêm từ từ V2 ml dung dịch HCl a M vào hệ. Gọi V (ml) là tổng thể tích dung dịch NaOH và dung dịch HCl được thêm vào ở trên. Khối lượng kết tủa trong hệ phụ thuộc vào giá trị V được biểu diễn như đồ thị bên dưới.
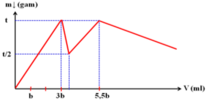
Giá trị tối thiểu của V để lượng kết tủa bị hòa tan hết là
A. 165,0
B. 525,0
C. 360,0
D. 420,0.
Hấp thụ hết 0,1 mol CO2 vào dung dịch có chứa 0,08 mol NaOH và 0,1 mol Na2CO3, thu được dung dịch X. Nhỏ từ từ dung dịch HCl vào dung dịch X đến khi thoát ra 0,08 mol khí CO2 thì thấy hết x mol HCl. Giá trị x là
A. 0,16
B. 0,15
C. 0,18
D. 0,17
Có 4 dung dịch (đều có nồng độ mol 0,1 mol/l). Mỗi dung dịch có chứa một trong 4 chất tan sau: NaCl, C2H5OH, CH3COOH, K2SO4. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau đây?
A. NaCl < C2H5OH<CH3COOH<K2SO4
B. C2H5OH< CH3COOH<K2SO4< NaCl
C. CH3COOH<K2SO4< NaCl < C2H5OH
D. C2H5OH<CH3COOH< NaCl < K2SO4
Đáp án D
C2H5OH ko là chất điện li nên khả năng dẫn điện kém nhất
CH3COOH là chất điện li yếu nên tổng nồng độ các ion < 0,2 mol
NaCl → Na++ Cl-
0,1 0,1 0,1
Tổng nồng độ các ion là 0,2M
K2SO4→ 2K++ SO42-
0,1 0,2 0,1
Tổng nồng độ các ion là 0,3M
Do đó độ dẫn điện C2H5OH<CH3COOH< NaCl < K2SO4
Cho dung dịch X chứa hỗn hợp gồm CH3COOH 0,1 M và CH3COONa 0,1 M. Biết ở 25°C, K của CH3COOH là 1,75.10-5 và bỏ qua sự phân li của nước. Giá trị pH của dung dịch X ở 25°C là:
A. 1,00
B. 4,24
C. 2,88
D. 4,76
Vì muối CH3COONa là chất điện li mạnh nên ta có
![]()
Do đó sau quá trình trên trong dung dịch có nồng độ của ion CH3COO- là 0,1.
Xét cân bằng điện li: CH3COOH + H2O ⇌ CH3COO- + H3O+
Nồng độ ban đầu: 0,1 0,1 0
Nồng độ phân li: x(M) → x x
Nồng độ cân bằng: 0,1 – x 0,1 + x x
Thay các giá trị ở trạng thái cân bằng vào công thức tính hằng số điện li thì ta có
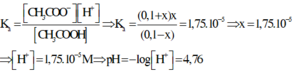
Đáp án D.