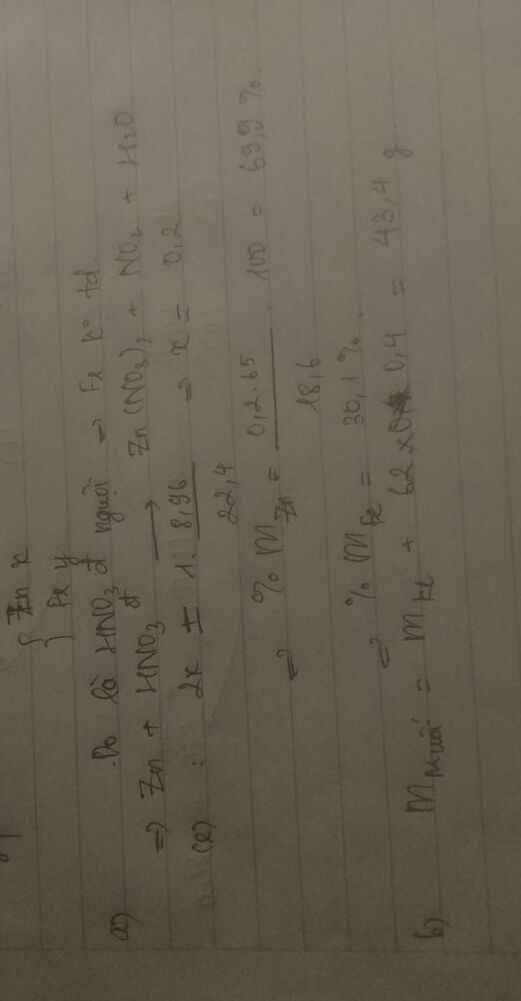hòa tan 11g hỗn hợp nhôm bằng dd HCl thu đc 8,96 lít (đktc). tính khối lượng sản phẩm có trong hỗn hợp ban đầu

Những câu hỏi liên quan
Hòa tan hoàn toàn 11g hỗn hợp sắt và nhôm cần vừa đủ m gam dd HCL 9,125% thu được 8,96 lít khí hiđro (đktc) 𝐚) Tính phần trăm theo khối lượng của kim loại trong hỗn hợp ban đầu 𝐛) Tính m 𝐜) Tính nồng độ phần trăm các chất có trong dung dịch sau phản ứng.
\(a)n_{H_2}=\dfrac{8,96}{22,4}=0,4mol\\ n_{Fe}=a;n_{Al}=b\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Rightarrow\left\{{}\begin{matrix}56a+27b=11\\a+1,5b=0,4\end{matrix}\right.\\ \Rightarrow a=0,1;b=0,2\)
\(\%m_{Fe}=\dfrac{0,1.56}{11}\cdot100=50,91\%\\ \%m_{Al}=100-50,91=49,09\%\)
\(b)Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 0,2 0,1 0,1
\(2Al+6HCl\rightarrow2AlCl_2+3H_2\)
0,2 0,6 0,2 0,3
\(m_{HCl}=\dfrac{\left(0,2+0,6\right).36,5}{9,125}\cdot100=320g\)
\(c)m_{dd}=320+11-0,1.2-0,3.2=308,2g\)
\(C_{\%FeCl_2}=\dfrac{0,1.127}{308,2}\cdot100=4,12\%\\ C_{\%AlCl_3}=\dfrac{0,2.133,5}{308,2}\cdot100=8,66\%\)
Đúng 2
Bình luận (0)
Hòa tan 11g hỗn hợp bột Al và Fe vào dung dịch HCl (dư) thu được 8,96 lít H2 (đktc)a) Tính thành phần % theo khối lượng từng kim loại trong hỗn hợp đầub) Tính khối lượng muối tan thu đượcc) Nếu hòa tan hoàn toàn 2 kim loại trên bằng dung dịch axit H2SO4 đặc nóng thì thể tích khí SO2 thu được ở điều kiện tiêu chuẩn là bao nhiêu ?
Đọc tiếp
Hòa tan 11g hỗn hợp bột Al và Fe vào dung dịch HCl (dư) thu được 8,96 lít H2 (đktc)
a) Tính thành phần % theo khối lượng từng kim loại trong hỗn hợp đầu
b) Tính khối lượng muối tan thu được
c) Nếu hòa tan hoàn toàn 2 kim loại trên bằng dung dịch axit H2SO4 đặc nóng thì thể tích khí SO2 thu được ở điều kiện tiêu chuẩn là bao nhiêu ?
a) Đặt \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow27a+56b=11\) (1)
Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Bảo toàn electron: \(3a+2b=0,4\cdot2=0,8\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2\cdot27}{11}\cdot100\%\approx49,09\%\\\%m_{Fe}=50,91\%\end{matrix}\right.\)
b) Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{AlCl_3}=n_{Al}=0,2\left(mol\right)\\n_{FeCl_2}=n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{muối}=m_{AlCl_3}+m_{FeCl_2}=0,2\cdot133,5+0,1\cdot127=39,4\left(g\right)\)
c) Bảo toàn electron: \(3\cdot0,2+3\cdot0,1=2n_{SO_2}\)
\(\Rightarrow n_{SO_2}=0,45\left(mol\right)\) \(\Rightarrow V_{SO_2}=0,45\cdot22,4=10,08\left(l\right)\)
Đúng 2
Bình luận (0)
a) Gọi nAl = x, nFe = y
Có 27x + 56y = 11 (1)
Bảo toàn e
3x + 2y = 2.0,4 (2)
Từ 1 và 2 => x = 0,2, y = 0,1
\(\%mAl=\dfrac{0,2.27}{11}.100\%=49,09\%\)
\(\%mFe=100-49,09=50,91\%\)
b) BTKL:
m muối = mkim loại + mHCl - mH2
= 11 + 0,4.2.36,5 - 0,4.2 = 39,4g
c)
Bảo toàn e
Al => Al+3 + 3e S+6 + 2e => S+4
0,2 0,6 2x x
Fe => Fe+3 + 3e
0,1 0,3
=> 2x = 0,6 + 0,3 => x = 0,45 mol
=> VSO2 = 0,45.22,4 = 10,08 lít
Đúng 1
Bình luận (0)
Lấy 1 hỗn hợp bột Al và Fe2O3 đem phản ứng nhiệt nhôm (không không khí). Để nguội sản phẩm sau đó chia thành 2 phần không đều nhau. P1 cho tác dụng với dd NaOH dư thu 8,96 (lit) H2 đktc) và phần ko tan có khối lượng bằng 44,8% khối lượng P1. P2 hoà tan hoàn toàn trong dd HCl thu 2,688 (lit) H2 (đktc). Tính m hh ban đầu. A. 57,5 B. 83,21 C. 53,20 D. 50,54
Đọc tiếp
Lấy 1 hỗn hợp bột Al và Fe2O3 đem phản ứng nhiệt nhôm (không không khí). Để nguội sản phẩm sau đó chia thành 2 phần không đều nhau. P1 cho tác dụng với dd NaOH dư thu 8,96 (lit) H2 đktc) và phần ko tan có khối lượng bằng 44,8% khối lượng P1. P2 hoà tan hoàn toàn trong dd HCl thu 2,688 (lit) H2 (đktc). Tính m hh ban đầu.
A. 57,5
B. 83,21
C. 53,20
D. 50,54
Đáp án A
P 1 : n H 2 = 0 , 4 m o l → n A l = 0 , 8 3 m o l
Vì có Al dư nên Fe2O3 chuyển hết thành Fe
Gọi số mol các chất trong phần 1 là: 2a mol Fe; a mol Al2O3; b mol Al
Phần hai sẽ có thành phần các chất là: 2ak mol Fe; ak mol Al2O3; bk mol Al
P 1 : n A l = b = 0 , 8 3 m o l
Và m F e = 44 , 8 % . m P 1 → 112 a = 0 , 448 ( 112 a + 102 a + 27 b ) → 4 a = 3 b
P 2 : n H 2 = 2 a k + 1 , 5 b k = 0 , 12 m o l
Giải hệ 3 phương trình 3 ẩn trên ta được:
a = 0,2 mol ; k = 0,15
→ m2= 0,15m1
→ m = 1,15m1 = 57,5g
Đúng 0
Bình luận (0)
Lấy 1 hỗn hợp bột Al và Fe2O3 đem phản ứng nhiệt nhôm (không không khí). Để nguội sản phẩm sau đó chia thành 2 phần không đều nhau. P1 cho tác dụng với dd NaOH dư thu 8,96 (lit) H2 đktc) và phần ko tan có khối lượng bằng 44,8% khối lượng P1. P2 hoà tan hoàn toàn trong dd HCl thu 2,688 (lit) H2 (đktc). Tính m hh ban đầu. A. 57,5 B. 83,21 C. 53,20 D. 50,54
Đọc tiếp
Lấy 1 hỗn hợp bột Al và Fe2O3 đem phản ứng nhiệt nhôm (không không khí). Để nguội sản phẩm sau đó chia thành 2 phần không đều nhau. P1 cho tác dụng với dd NaOH dư thu 8,96 (lit) H2 đktc) và phần ko tan có khối lượng bằng 44,8% khối lượng P1. P2 hoà tan hoàn toàn trong dd HCl thu 2,688 (lit) H2 (đktc). Tính m hh ban đầu.
A. 57,5
B. 83,21
C. 53,20
D. 50,54

Giải hệ 3 phương trình 3 ẩn trên ta được:
a = 0,2 mol; k = 0,15
→ m2= 0,15m1
→ m = 1,15.m1 = 57,5g
Đúng 0
Bình luận (0)
Lấy 1 hỗn hợp bột Al và Fe2O3 đem phản ứng nhiệt nhôm (không không khí). Để nguội sản phẩm sau đó chia thành 2 phần không đều nhau. P1 cho tác dụng với dd NaOH dư thu 8,96 (lit) H2(đktc) và phần ko tan có khối lượng 44,8% khối lượng P1. P2 hoà tan hoàn toàn trong dd HCl thu 2,688 (lit) H2 (đktc). Tính m hh ban đầu. A. 83,21 B. 53,20 C. 50,54 D. 57,5
Đọc tiếp
Lấy 1 hỗn hợp bột Al và Fe2O3 đem phản ứng nhiệt nhôm (không không khí). Để nguội sản phẩm sau đó chia thành 2 phần không đều nhau. P1 cho tác dụng với dd NaOH dư thu 8,96 (lit) H2(đktc) và phần ko tan có khối lượng = 44,8% khối lượng P1. P2 hoà tan hoàn toàn trong dd HCl thu 2,688 (lit) H2 (đktc). Tính m hh ban đầu.
A. 83,21
B. 53,20
C. 50,54
D. 57,5
Đáp án : D
P1 : nH2 = 0,4 mol => nAl = 0,8/3 (mol)
Vì có Al dư nên Fe2O3 chuyển hết thành Fe
Gọi số mol các chất trong phần 1 là : 2a mol Fe ; a mol Al2O3 ; b mol Al
Phần hai sẽ có thành phần các chất là : 2ak mol Fe ; ak mol Al2O3 ; bk mol Al
P1 : nAl = b = 0,8/3 (mol)
Và mFe = 44,8%.mP1 => 112a = 0,448( 112a + 102a + 27b) => 4a = 3b
P2 : nH2 = 2ak + 1,5bk = 0,12 mol
Giải hệ 3 phương trình 3 ẩn trên ta được :
,a = 0,2 mol ; k = 0,15
=> m2 = 0,15m1
=> m = 1,15m1 = 57,5g
Đúng 0
Bình luận (0)
Hòa tan 1,95 gam hỗn hợp Al và Fe bằng dd HNO3 dư thu đc 2,688 lít khí NO2 ( đktc, sản phẩm khử duy nhất) và dd chứa m gam muối.
a)viết các phương trình hóa học xảy ra
b)tính khối lượng mỗi kim loại trong hỗn hợp ban đầu
c) tính m
a) PTHH: Al + 6 HNO3 -> Al(NO3)3 + 3 NO2 + 3 H2O
x___________6x________x________3x(mol)
Fe + 6 HNO3 -> Fe(NO3)3 + 3 NO2 + 3 H2O
y___6y______y____________3y(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}27x+56y=1,95\\22,4.3x+22,4.3y=2,688\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,01\\y=0,03\end{matrix}\right.\)
b) Khối lượng mỗi kim loại trong hỗn hợp ban đầu:
mAl=27x=27 . 0,01=0,27(g)
mFe=56y= 56 . 0,03= 1,68(g)
c) m=m(muối)=mAl(NO3)3 + mFe(NO3)3= 213x+242y=213.0,01+ 242.0,03=9,39(g)
Đúng 1
Bình luận (0)
Tiến hành nhiệt nhôm hoàn toàn 48,3 gam hỗn hợp bột Al và
Fe
3
O
4
rồi hòa tan hết hỗn hợp sau phản ứng bằng dung dịch HCl thu được 13,44 lít
H
2
(đktc). Khối lượng nhôm trong hỗn hợp ban đầu là A. 13,5 B. 16 C. 18 D. cả A và C đúng
Đọc tiếp
Tiến hành nhiệt nhôm hoàn toàn 48,3 gam hỗn hợp bột Al và Fe 3 O 4 rồi hòa tan hết hỗn hợp sau phản ứng bằng dung dịch HCl thu được 13,44 lít H 2 (đktc). Khối lượng nhôm trong hỗn hợp ban đầu là
A. 13,5
B. 16
C. 18
D. cả A và C đúng
Tiến hành nhiệt nhôm hoàn toàn 14,49 gam hỗn hợp bột Al và
Fe
3
O
4
rồi hòa tan hết hỗn hợp sau phản ứng bằng dung dịch HCl thu được 4,032 lít
H
2
(đktc). Khối lượng nhôm trong hỗn hợp ban đầu là A. 4,05 B. 3,24 C. 4,32 D. cả A và C đúng
Đọc tiếp
Tiến hành nhiệt nhôm hoàn toàn 14,49 gam hỗn hợp bột Al và Fe 3 O 4 rồi hòa tan hết hỗn hợp sau phản ứng bằng dung dịch HCl thu được 4,032 lít H 2 (đktc). Khối lượng nhôm trong hỗn hợp ban đầu là
A. 4,05
B. 3,24
C. 4,32
D. cả A và C đúng
Hòa tan M gam hỗn hợp Zn và Fe trong dd HCl dư thu đc 39g muối và 6,72 lít khí (đktc).
a. Tính % khối lượng từng chất trong hỗn hợp ban đầu.
b. Tính nồng độ phần trăm của 200g dd HCl.