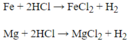Tính m Fe khi tác dụng với 0,3 mol HCl. a)VPTHH b)tính m(Fe)

Những câu hỏi liên quan
Nung hỗn hợp gồm 0,3 mol Fe và 0,2 mol S cho đến khi kết thúc phản ứng thu được chất rắn A. Cho A tác dụng với dung dịch HCl dư, thu được khí B. Tỉ khối của B so với không khí là
A. 0,8045
B. 0,7560
C. 0,7320
D. 0,9800
Bài 1.
Cho 21.1g (Zn,Al) tác dụng với HCl dư 14.56 lít H2
a) Phương trình PỨ
b) % m mỗi kim loại
c) m muối
Bài 2.
10g ( Fe, Cu) t.dụng HCl dư
--} m(g) rắn +2.24 lít H2
m=?
Bài 3.
2.2g ( Fe, Al) tác dụng với 2.016 lít Cl2 ( ₫kc)
a) tính % m mỗi kim loại
b) m muối ?
Bài 4.
21.1g ( Zn, ZnO) + HCl 1M --> 0.2 mol H2
a) tính % m mỗi chất
b) tính V HCl
Giải giùm em đi ạ em cảm ơn ạ, em ngu hóa lắm hic
Xem chi tiết
Bài 1:
a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
b, Giả sử: \(\left\{{}\begin{matrix}n_{Zn}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
⇒ 65x + 27y = 21,1 (1)
Ta có: \(n_{H_2}=0,65\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}+\dfrac{3}{2}n_{Al}=x+\dfrac{3}{2}y\left(mol\right)\)
\(\Rightarrow x+\dfrac{3}{2}y=0,65\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,2.65}{21,1}.100\%\approx61,6\text{% }\\\%m_{Al}\approx38,4\%\end{matrix}\right.\)
c, Theo PT: \(\left\{{}\begin{matrix}n_{ZnCl_2}=n_{Zn}=0,2\left(mol\right)\\n_{AlCl_3}=n_{Al}=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{ZnCl_2}=0,2.136=27,2\left(g\right)\\m_{AlCl_3}=0,3.133,5=40,05\left(g\right)\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
Bài 2: Cu không tác dụng với dd HCl nên cr thu được là Cu.
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow m_{cr}=m_{Cu}=10-5,6=4,4\left(g\right)\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (1)
Bài 3:
PT: \(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
\(2Al+3Cl_2\underrightarrow{t^o}2AlCl_3\)
a, Giả sử: \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
⇒ 56x + 27y = 2,2 (1)
Ta có: \(n_{Cl_2}=0,09\left(mol\right)\)
Theo PT: \(n_{Cl_2}=\dfrac{3}{2}n_{Fe}+\dfrac{3}{2}n_{Al}=\dfrac{3}{2}x+\dfrac{3}{2}y\left(mol\right)\)
\(\Rightarrow\dfrac{3}{2}x+\dfrac{3}{2}y=0,09\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,02\left(mol\right)\\y=0,04\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,02.56}{2,2}.100\%\approx50,91\%\\\%m_{Al}\approx49,09\%\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{FeCl_3}=n_{Fe}=0,02\left(mol\right)\\n_{AlCl_3}=n_{Al}=0,04\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{FeCl_3}=0,02.162,5=3,25\left(g\right)\\m_{AlCl_3}=0,04.133,5=5,34\left(g\right)\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Cho m gam KMnO4tác dụng hết với dung dịch HCl (đặc) dư, toàn bộ khí clo sinh ra tác dụng hết với Fe dư, thu được 16,25 gam FeCl3. Tính số mol HCl phản ứng và giá trị m
Đọc tiếp
Cho m gam KMnO4tác dụng hết với dung dịch HCl (đặc) dư, toàn bộ khí clo sinh ra tác dụng hết với Fe dư, thu được 16,25 gam FeCl3. Tính số mol HCl phản ứng và giá trị m
cho 5,6g Fe tác dụng với HCl 2M tính nồng độ mol của chất có trong dung dịch sau khi phản ứng kết thúc biết Fe = 56, H = 1, Cl = 35,5
n Fe = 5,6/56 = 0,1 mol
Fe + 2HCl → FeCl2 + H2
Theo PTHH :
n HCl = 2n Fe = 0,1.2 = 0,2(mol)
=> V dd = V dd HCl = 0,2/2 = 0,1(lít)
n FeCl2 = n Fe = 0,1(mol)
=> CM FeCl2 = 0,1/0,1 = 1M
Đúng 1
Bình luận (0)
Tính khối lượng a) 0,2 (mol) Fe+0,3 mol Cứ b) 0,5 (mol) H2SO4 Cho M . Fe=56, Cu=64, H=1, S=32, O=16 (Ai giúp mình với)
a) mhh = 0,2.56+0,3.64 = 30,4 (g)
b) \(m_{H_2SO_4}=0,5.98=49\left(g\right)\)
Đúng 0
Bình luận (0)
Khi cho m gam Fe tác dụng vừa đủ với V lít dung dịch HNO3 thu được dung dịch
muối, 0,1 mol khí NO và 0,3 mol khí NO2. Xác định m.
A. 12,5g B. 11,5g C. 11,2g D. 15,2g.
Bảo toàn e :
\(n_{Fe}=\dfrac{3n_{NO}+n_{NO_2}}{3}=\dfrac{3\cdot0.1+0.3}{3}=0.2\left(mol\right)\)
\(m_{Fe}=0.2\cdot56=11.2\left(g\right)\rightarrow C\)
Đúng 1
Bình luận (0)
cho 0,03 mol Al và 0,05 mol Fe tác dụng với 100 ml dung dịch X chứa Cu(NO3)2 và AgNO3. sau khi các phản ứng xảy ra hoàn toàn, thu đucợ dung dịch Y và 8,12 gam chắt rắn Z gồm ba kim loại. Cho chất rắn Z tác dụng với dung dịch HCL dư, thu được 0,672 lít khí H2 (đktc). Cho biết các phản ứng xảy ra hoàn toàn. Nồng độ mol của Cu(NO3)2 và AgNO3 trong dung dịch X:A 0,3 M và 0,7 MB 0,4 M và 0,2 MC 0,4 M và 0,6 MD 0,5 M và 0,3 M
Đọc tiếp
cho 0,03 mol Al và 0,05 mol Fe tác dụng với 100 ml dung dịch X chứa Cu(NO3)2 và AgNO3. sau khi các phản ứng xảy ra hoàn toàn, thu đucợ dung dịch Y và 8,12 gam chắt rắn Z gồm ba kim loại. Cho chất rắn Z tác dụng với dung dịch HCL dư, thu được 0,672 lít khí H2 (đktc). Cho biết các phản ứng xảy ra hoàn toàn. Nồng độ mol của Cu(NO3)2 và AgNO3 trong dung dịch X:
A 0,3 M và 0,7 M
B 0,4 M và 0,2 M
C 0,4 M và 0,6 M
D 0,5 M và 0,3 M
cho hỗn hợp gồm Fe,Al tác dụng với 200ml dd HCl. a(M) thu được 1,456l khí thoát ra và dung dich X
a) tính % khối lượng của kim loại trong hỗn hợp
b) tính nồng độ mol các chất trong dd X
c) tính a
a)\(\left\{{}\begin{matrix}Fe:a\left(mol\right)\\Al:b\left(mol\right)\end{matrix}\right.\)⇒ 56a + 27b = 1,93(1)
\(Fe + 2HCl \to FeCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\)
Theo PTHH : a + 1,5b = \(\dfrac{1,456}{22,4} = 0,065\)(2)
Từ (1)(2) suy ra : a = 0,02 ; b = 0,03
Vậy :
\(\%m_{Fe} = \dfrac{0,02.56}{1,93}.100\% = 58,03\%\\ \%m_{Al} = 100\% - 58,03\% = 41,97\%\)
b)
\(C_{M_{FeCl_2}} = \dfrac{0,02}{0,2} = 0,1M\\ C_{M_{AlCl_3}} = \dfrac{0,03}{0,2} = 0,15M\)
c)
\(n_{HCl} = 2n_{H_2} = 0,065.2 = 0,13(mol)\\ a = \dfrac{0,13}{0,2} = 0,65(M)\)
Đúng 1
Bình luận (0)
mn thêm vào đề bài giúp mình là hỗn hợp gồm 1,93g Fe,Al nha
Đúng 0
Bình luận (0)
Cho hỗn hợp gồm Fe, Mg có khối lượng 8g tác dụng hết với dung dịch HCl thu được 4,48 lít khí H2 (đktc).
a) Viết phương trình hóa học của Fe và Mg với dung dịch HCl.
b) Tính tỉ lệ theo số mol của Fe và của Mg trong hỗn hợp ban đầu (Fe=56, Mg=24)