Dẫn 6,72 lít( đktc) hỗn hợp CH4 , C2H4, C2H2 vào dd AgNo3 trong NH3 dư sinh ra M (g) ktủa màu vàng và còn 4,48 lít (đktc) hỗn hợp khí X. Hấp thụ X vào br2 dư thấy dd bị nhạt màu và bay ra 0,56 lít ( đktc) khí Y a) viết ptpu xảy ra . Tính % thể tích mỗi khí trong hỗn hợp đầu b) tính khối lượng kết tủa màu vàng thu được

Những câu hỏi liên quan
Cho 33,6 lít hỗn hợp X( đktc ) gồm C2H2 , C2H4 và CH4 vào dd AgNO3/NH3 dư thì thu được 144 g kết tủa màu vàng. Hỗn hợp khí còn lại cho lội qua dd brom dư thì có 11,2 lít khí thoát ra ( đktc ) . a. Viết các phương trình hóa học xảy ra? b. Tính khối lượng từng khí trong hỗn hợp?c. Đime hóa lượng axetilen trên. Viết phương trình phản ứng? Tính m sản phẩm tạo thành nếu H 80%
Đọc tiếp
Cho 33,6 lít hỗn hợp X( đktc ) gồm C2H2 , C2H4 và CH4 vào dd AgNO3/NH3 dư
thì thu được 144 g kết tủa màu vàng. Hỗn hợp khí còn lại cho lội qua dd brom dư thì có
11,2 lít khí thoát ra ( đktc ) .
a. Viết các phương trình hóa học xảy ra?
b. Tính khối lượng từng khí trong hỗn hợp?
c. Đime hóa lượng axetilen trên. Viết phương trình phản ứng? Tính m sản phẩm
tạo thành nếu H = 80%
a) \(n_X=\dfrac{33,6}{22,4}=1,5\left(mol\right);n_{C_2Ag_2}=\dfrac{144}{240}=0,4\left(mol\right);n_{CH_4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH:
\(C_2H_2+2AgNO_3+2NH_3\rightarrow C_2Ag_2\downarrow+2NH_4NO_3\)
0,4<---------------------------------0,4
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
b) \(n_{C_2H_4}=1,5-0,4-0,5=0,6\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{CH_4}=0,5.16=8\left(g\right)\\m_{C_2H_2}=0,4.26=10,4\left(g\right)\\m_{C_2H_4}=0,6.28=16,8\left(g\right)\end{matrix}\right.\)
c) \(2CH\equiv CH\xrightarrow[]{t^o,p,xt}CH\equiv C-CH=CH_2\)
0,4------------------>0,2
\(\Rightarrow m_{C_4H_4}=0,2.80\%.52=8,32\left(g\right)\)
Đúng 1
Bình luận (0)
Dẫn 6,72 lít (đkc) hỗn hợp metan, etilen, axetilen vào dung dịch AgNO3/NH3 dư thấy sinh ra m gam kết tủa vàng và còn 4,48 lít (đkc) hỗn hợp khí X, hấp thụ X vào dung dịch Brom dư thấy dung dịch bị nhạt màu và bay ra 1,12 lít(đkc) khí Y.
a/ Viết các PTPƯ xảy ra, tính phần trăm thể tích mỗi khí trong hỗn hợp đầu.
b/ Tính khối lượng kết tủa vàng thu được
Cho 4,48 lít hỗn hợp khí gồm CH4 và C2H2 qua dung dịch Br2 dư thấy dung dịch nhạt màu và có 2,24 lít khí thoát ra (các khí đo ở đktc). Thành phần % thể tích của CH4 trong hỗn hợp là A. 25% B. 50% C. 60% D. 37,5%
Đọc tiếp
Cho 4,48 lít hỗn hợp khí gồm CH4 và C2H2 qua dung dịch Br2 dư thấy dung dịch nhạt màu và có 2,24 lít khí thoát ra (các khí đo ở đktc). Thành phần % thể tích của CH4 trong hỗn hợp là
A. 25%
B. 50%
C. 60%
D. 37,5%
Đáp án B
0,2 mol hh khí gồm CH4 và C2H2 qua dd brom dư thấy nhạt màu và có 0,1 mol khí thoát ra.
• Khí thoát ra là CH4 → nCH4 = 0,1 mol
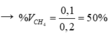
Đúng 0
Bình luận (0)
Dẫn 2,24 lít (đktc) hỗn hợp A (gồm C2H4 và C2H6) vào bình đựng dung dịch Br2, thấy bình Br2 bị nhạt màu và có khí thoát ra. Sau phản ứng thấy khối lượng bình Br2 tăng 1,40 gam. Tính % thể tích từng khí trong hỗn hợp A?
nhh khí = 2,24/22,4 = 0,1 (mol)
nC2H4 = 1,4/28 = 0,05 (mol)
%VC2H4 = 0,05/0,1 = 50%
%VC2H6 = 100% - 50% = 50%
Đúng 1
Bình luận (0)
Hỗn hợp X gồm etilen,propan,propin. dẫn 3,584 lít khí x(đktc) lần lượt qua 2 bình: bình 1 đựng dung dịch agno3/nh3 dư; bình 2 đựng 80 ml dung dịch Br2 1M. Thấy ở bình 1 có 5,88 gam kết tủa; dung dịch ở bình 2 bị nhạt bớt màu vàng và có 1,792 lít khí(đktc) thoát ra.a) Tính % thể tích mỗi khí trong hỗn hợp Xb) Nếu dẫn 1,792 lít hỗn hợp X ở trên vào 80 ml dung dịch Br2 1M thì hiện tượng phản ứng sẽ như thế nào? Vì sao?Giusp em câu này với ạ! Em cảm ơn nhiều
Đọc tiếp
Hỗn hợp X gồm etilen,propan,propin. dẫn 3,584 lít khí x(đktc) lần lượt qua 2 bình: bình 1 đựng dung dịch agno3/nh3 dư; bình 2 đựng 80 ml dung dịch Br2 1M. Thấy ở bình 1 có 5,88 gam kết tủa; dung dịch ở bình 2 bị nhạt bớt màu vàng và có 1,792 lít khí(đktc) thoát ra.
a) Tính % thể tích mỗi khí trong hỗn hợp X
b) Nếu dẫn 1,792 lít hỗn hợp X ở trên vào 80 ml dung dịch Br2 1M thì hiện tượng phản ứng sẽ như thế nào? Vì sao?
Giusp em câu này với ạ! Em cảm ơn nhiều
Ta có: \(n_X=\dfrac{3,584}{22,4}=0,16\left(mol\right)\)
- Cho hh khí quá bình 1:
PT: \(C_3H_4+AgNO_3+NH_3\rightarrow AgC_3H_3+NH_4NO_3\)
Ta có: \(n_{AgC_3H_3}=\dfrac{5,88}{147}=0,04\left(mol\right)\)
Theo PT: \(n_{C_3H_4}=n_{AgC_3H_3}=0,04\left(mol\right)\)
- Cho tiếp hh khí còn lại qua bình 2, thấy dd Br2 nhạt màu.
→ Br2 dư, C2H4 pư hết. Khí thoát ra là C3H8.
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Ta có: \(n_{C_3H_8}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
a, \(\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,16-0,08-0,04}{0,16}.100\%=25\%\\\%V_{C_3H_4}=\dfrac{0,04}{0,16}.100\%=25\%\\\%V_{C_3H_8}=50\%\end{matrix}\right.\)
b, Ta có: \(n_X=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
\(\Rightarrow X\left\{{}\begin{matrix}n_{C_2H_4}=0,08.25\%=0,02\left(mol\right)\\n_{C_3H_4}=0,08.25\%=0,02\left(mol\right)\\n_{C_3H_8}=0,04\left(mol\right)\end{matrix}\right.\) \(\Rightarrow n_{\pi}=n_{C_2H_4}+2n_{C_3H_4}=0,06\left(mol\right)\)
\(n_{Br_2}=0,08.1=0,08\left(mol\right)\)
⇒ nπ < nBr2
→ Br2 dư. Hiện tượng: Dd Br2 nhạt màu dần.
Đúng 2
Bình luận (0)
Dẫn 5,6 lít hỗn hợp khí CH4 và C2H2 (ở đktc) vào bình đựng dd brom dư. Sau phản ứng thấy có 48g Br2 đã tham gia phản ứng. Tính thể tích mỗi khí trong hỗn hợp khí ban đầu?
Ta có: \(n_{Br_2}=\dfrac{48}{160}=0,3\left(mol\right)\)
PT: \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
____0,15___0,3 (mol)
\(\Rightarrow\left\{{}\begin{matrix}V_{C_2H_2}=0,15.22,4=3,36\left(l\right)\\V_{CH_4}=2,24\left(l\right)\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (3)
$C_2H_2+2Br_2\to Br_2CH-CHBr_2$
$n_{Br_2}=\dfrac{48}{160}=0,3(mol)$
$\Rightarrow n_{C_2H_2}=\dfrac{n_{Br_2}}{2}=0,15(mol)$
$\Rightarrow V_{C_2H_2}=0,15.22,4=3,36(l)$
$\Rightarrow V_{CH_4}=5,6-3,36=2,24(l)$
Đúng 0
Bình luận (0)
Dẫn 11,2 lít (đktc) hỗn hợp khí gồm CH4, C2H4, C2H2 qua bình đựng nước brom dư thấy có 6,72 lít (đktc) khí thoát ra khỏi bình, đồng thời khối lượng bình tăng 5,4 gam. Tính % thể tích các chất trong X?
dẫn 10,08 lít hh x gồm:c2h2,c2h4,ch4 qua dd agno3/nh3 dư thì thu được 24g kết tủa.Hỗn hợp khí còn lại vào nước br2 dư thì có 3,36 lít khí thoát ra
a) viết các phương trình phản ứng xảy ra
b) tính % khối lượng của từng khí trong hh x?
Dẫn 8,96 lít hỗn hợp khí X gồm metan và etilen vào dung dịch brom dư, thấy dung dịch nhạt màu và còn lại 2,24 lít khí thoát ra. (Thể tích các khí đều do(đktc)). Thành phần phần trăm thể tích của metan trong X là
A. 25,0%
B. 50,0%
C. 60,0%
D. 37,5%
Đáp án A
Hướng dẫn
Chất khí thoát ra là CH4 => thể tích CH4 là 2,24 lít
=> % V C H 4 = 2 , 24 8 , 96 .100% = 25%
Đúng 0
Bình luận (0)