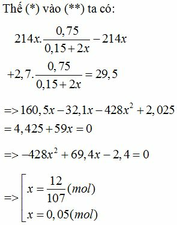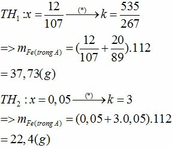Hòa tan 13, 9g hỗn hợp nhôm sắt trong dung dịch h2 SO4 loãng dư, thấy có 7,84 lít khí h2 bay ra ở điều kiện tiêu chuẩn viết phương trình hóa học xảy ra

Những câu hỏi liên quan
Hòa tan hoàn toàn 21,6 g hỗn hợp Fe và Fe2 O3 bằng dung dịch H2 SO4 loãng dư sau phản ứng thu được 2,24 lít khí H2 ở điều kiện tiêu chuẩn a viết các phương trình hóa học xảy ra .Tính %khối lượng từng chất trong hỗn hợp đều
a, PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
b, Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1.56}{21,6}.100\%\approx25,93\%\\\%m_{Fe_2O_3}\approx100-25,93=74,07\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
a, PT: Fe+H2SO4→FeSO4+H2��+�2��4→����4+�2
Fe2O3+3H2SO4→Fe2(SO4)3+3H2O��2�3+3�2��4→��2(��4)3+3�2�
b, Ta có: ⇒⎧⎪⎨⎪⎩%mFe=0,1.5621,6.100%≈25,93%%mFe2O3≈100−25,93=74,07%
Đúng 0
Bình luận (0)
Tiến hành phản ứng nhiệt nhôm với Fe2O3 trong điều kiện không có không khí. Chia hỗn hợp sau phản ứng thành hai phần. Phần một có khối lượng 67 gam cho tác dụng với lượng dư dung dịch NaOH thấy có 16,8 lít H2 bay ra. Hòa tan phần hai bằng một lượng dư dung dịch HCl thấy có 84 lít H2 bay ra. Biết các phản ứng xảy ra hoàn toàn và các thể tích khí đo ở điều kiện tiêu chuẩn. Khối lượng Fe thu được trong quá trình nhiệt nhôm là A. 112 B. 84 C. 168 D. 56
Đọc tiếp
Tiến hành phản ứng nhiệt nhôm với Fe2O3 trong điều kiện không có không khí. Chia hỗn hợp sau phản ứng thành hai phần. Phần một có khối lượng 67 gam cho tác dụng với lượng dư dung dịch NaOH thấy có 16,8 lít H2 bay ra. Hòa tan phần hai bằng một lượng dư dung dịch HCl thấy có 84 lít H2 bay ra. Biết các phản ứng xảy ra hoàn toàn và các thể tích khí đo ở điều kiện tiêu chuẩn. Khối lượng Fe thu được trong quá trình nhiệt nhôm là
A. 112
B. 84
C. 168
D. 56
Đáp án A
Hỗn hợp rắn gồm Al, Al2O3, Fe với n Fe = 2 n Al 2 O 3 . Chia thành 2 phần không bằng nhau:
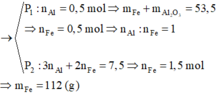
Đúng 0
Bình luận (0)
Tiến hành phản ứng nhiệt nhôm với Fe2O3 trong điều kiện không có không khí. Chia hỗn hợp sau phản ứng thành hai phần. Phần một có khối lượng 67 gam cho tác dụng với lượng dư dung dịch NaOH thấy có 16,8 lít H2 bay ra. Hòa tan phần hai bằng một lượng dư dung dịch HCl thấy có 84 lít H2 bay ra. Biết các phản ứng xảy ra hoàn toàn và các thể tích khí đo ở điều kiện tiêu chuẩn. Khối lượng Fe thu được trong quá trình nhiệt nhôm là A. 112. B. 84. C. 168. D. 56.
Đọc tiếp
Tiến hành phản ứng nhiệt nhôm với Fe2O3 trong điều kiện không có không khí. Chia hỗn hợp sau phản ứng thành hai phần. Phần một có khối lượng 67 gam cho tác dụng với lượng dư dung dịch NaOH thấy có 16,8 lít H2 bay ra. Hòa tan phần hai bằng một lượng dư dung dịch HCl thấy có 84 lít H2 bay ra. Biết các phản ứng xảy ra hoàn toàn và các thể tích khí đo ở điều kiện tiêu chuẩn. Khối lượng Fe thu được trong quá trình nhiệt nhôm là
A. 112.
B. 84.
C. 168.
D. 56.
cho 11 gam hỗn hợp 2 kim loại gồm nhôm và sắt tác dụng vừa đủ với dung dịch h2 SO4 loãng 2M sau phản ứng thấy thoát ra 8,96 lít ở điều kiện tiêu chuẩn
Viết các phương trình hóa học
tính thành phần phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu
Tính thể tích dung dịch h2 SO4 cần dùng
Xem chi tiết
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Fe + H2SO4 → FeSO4 + H2
nH2=\(\dfrac{8,96}{22,4}\)= 0,4 mol
Gọi số mol của Al và Fe trong 11 gam hỗn hợp là x và y mol ta có:
\(\left\{{}\begin{matrix}27x+56y=11\\1,5x+y=0,4\end{matrix}\right.\)=> x = 0,2 và y = 0,1
Theo tỉ lệ phương trình => nH2SO4 cần dùng = nH2 = 0,4 mol
=> VH2SO4 cần dùng = \(\dfrac{0,4}{2}\)= 0,2 lít
%mAl = \(\dfrac{0,2.27}{11}.100\)= 49,1% => %mFe = 100- 49,1 = 50,9%
Đúng 1
Bình luận (0)
Tiến hành phản ứng nhiệt nhôm với sắt(III) oxit trong điều kiện không có không khí, thu được hỗn hợp A. Chia hỗn hợp A ( đã trộn đều) thành hai phần. Phần thứ nhất có khối lượng ít hơn phần thứ hai là 26,8 gam. Cho phần thứ nhất tác dụng với lượng dư dung dịch NaOH thấy có 3,36 lít khí H2 bay ra. Hòa tan phần thứ hai bằng lượng dư dung dịch HCl thấy có 16,8 lít H2 bay ra. Biết các phản ứng xảy ra với hiệu suất 100%, các thể tích khí đo ở điều kiện tiêu chuẩn. Tính khối lượng Fe có trong hỗn hợp...
Đọc tiếp
Tiến hành phản ứng nhiệt nhôm với sắt(III) oxit trong điều kiện không có không khí, thu được hỗn hợp A. Chia hỗn hợp A ( đã trộn đều) thành hai phần. Phần thứ nhất có khối lượng ít hơn phần thứ hai là 26,8 gam. Cho phần thứ nhất tác dụng với lượng dư dung dịch NaOH thấy có 3,36 lít khí H2 bay ra. Hòa tan phần thứ hai bằng lượng dư dung dịch HCl thấy có 16,8 lít H2 bay ra. Biết các phản ứng xảy ra với hiệu suất 100%, các thể tích khí đo ở điều kiện tiêu chuẩn. Tính khối lượng Fe có trong hỗn hợp A.
hòa tan hoàn toàn 30,5 g hỗn hợp kim loại x y z có hóa trị tương ứng là a b c trong dung dịch h2 so4 loãng sau phản ứng thấy có v lít khí thoát ra ở điều kiện tiêu chuẩn và 97,7 gam hỗn hợp muối khan tính v
Xem chi tiết
\(Gọi\ n_{H_2} = n_{H_2SO_4} = a(mol)\)
Bảo toàn khối lượng :
\(30,5 + 98a = 2a + 97,7\\ \Rightarrow a = 0,7(mol)\\ \Rightarrow V = 0,7.22,4 = 15,68(lít)\)
Đúng 4
Bình luận (1)
Gọi \(n_{H_2}=n_{H_2SO_4}=a\text{ ( mol )}\)
Áp dụng định luật bảo toàn khối lượng ta có :
30,5 + 98a = 2a + 97,7
⇒ a = 0,7 ( mol )
=> V = 0,7 . 22,4 = 15,68 ( lít )
Đúng 1
Bình luận (0)
Tiến hành phản ứng nhiệt nhôm với Fe2O3 trong điều kiện không có không khí. Chia hỗn hợp thu được sau phản ứng (đã trộn đều) thành 2 phần không bằng nhau. Phần 2 có khối lượng nhiều hơn phần 1 là 134 gam. Cho phần 1 tác dụng với lượng dư dung dịch NaOH thấy có 16,8 lít khí H2 bay ra. Hòa tan phần 2 bằng lượng dư dung dịch H2SO4 loãng thấy có 84 lít khí H2 bay ra. Các phản ứng đều xảy ra với hiệu suất 100%. Các khí đo ở đktc. Khối lượng Fe tạo thành trong phản ứng nhiệt nhôm gần nhất là A. 186,0...
Đọc tiếp
Tiến hành phản ứng nhiệt nhôm với Fe2O3 trong điều kiện không có không khí. Chia hỗn hợp thu được sau phản ứng (đã trộn đều) thành 2 phần không bằng nhau. Phần 2 có khối lượng nhiều hơn phần 1 là 134 gam. Cho phần 1 tác dụng với lượng dư dung dịch NaOH thấy có 16,8 lít khí H2 bay ra. Hòa tan phần 2 bằng lượng dư dung dịch H2SO4 loãng thấy có 84 lít khí H2 bay ra. Các phản ứng đều xảy ra với hiệu suất 100%. Các khí đo ở đktc. Khối lượng Fe tạo thành trong phản ứng nhiệt nhôm gần nhất là
A. 186,0 gam.
B. 112,0 gam.
C. 192,2 gam.
D. 117,6 gam.
Đáp án B
![]()
· Phần 1 + NaOH → 0,75 mol H2
=> Al dư, Fe2O3 phản ứng hết.
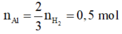
· Đặt số mol Fe, A l 2 O 3 trong phần 1 lần lượt là 2x, x.
Giả sử phần 2 có khối lượng gấp k lần phần 1.
![]() (1)
(1)
Phần 2:
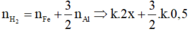
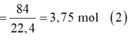
· Từ (1) và (2) suy ra:
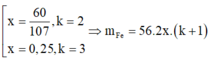
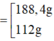
Kết hợp đáp án suy ra m F e = 112 g
Đúng 0
Bình luận (0)
Tiến hành phản ứng nhiệt nhôm với Fe2O3 trong điều kiện không có không khí. Chia hỗn hợp thu được sau phản ứng (đã trộn đều) thành 2 phần không bằng nhau. Phần 2 có khối lượng nhiều hơn phần 1 là 134 gam. Cho phần 1 tác dụng với lượng dư dung dịch NaOH thấy có 16,8 lít khí H2 bay ra. Hòa tan phần 2 bằng lượng dư dung dịch H2SO4 loãng thấy có 84 lít khí H2 bay ra. Các phản ứng đều xảy ra với hiệu suất 100%. Các khí đo ở đktc. Khối lượng Fe tạo thành trong phản ứng nhiệt nhôm gần nhất là A. 186,0...
Đọc tiếp
Tiến hành phản ứng nhiệt nhôm với Fe2O3 trong điều kiện không có không khí. Chia hỗn hợp thu được sau phản ứng (đã trộn đều) thành 2 phần không bằng nhau. Phần 2 có khối lượng nhiều hơn phần 1 là 134 gam. Cho phần 1 tác dụng với lượng dư dung dịch NaOH thấy có 16,8 lít khí H2 bay ra. Hòa tan phần 2 bằng lượng dư dung dịch H2SO4 loãng thấy có 84 lít khí H2 bay ra. Các phản ứng đều xảy ra với hiệu suất 100%. Các khí đo ở đktc. Khối lượng Fe tạo thành trong phản ứng nhiệt nhôm gần nhất là
A. 186,0 gam.
B. 112,0 gam.
C. 192,2 gam.
D. 117,6 gam.
Đáp án B.
2 A l + F e 2 O 3 → t o A l 2 O 3 + 2 F e
· Phần 1 + NaOH → 0,75 mol H2
=> Al dư, Fe2O3 phản ứng hết.
n A l = 2 3 n H 2 = 0 , 5 m o l
· Đặt số mol Fe, A l 2 O 3 trong phần 1 lần lượt là 2x, x.
Giả sử phần 2 có khối lượng gấp k lần phần 1.
=> (27.0,5 + 56.2x + 102x).(k – 1)=134 (1)
· Phần 2:
n H 2 = n F e + 3 2 n A l ⇒ k . 2 x + 3 2 k . 0 , 5 = 84 22 , 4 = 3 , 75 m o l ( 2 )
· Từ (1) và (2) suy ra:
x = 60 107 ; k = 2 x = 0 , 25 ; k = 3 ⇒ m F e = 56 . 2 x . ( k + 1 ) = 188 , 4 g 112 g
Kết hợp đáp án suy ra
m
F
e
=
112
g
.
Đúng 0
Bình luận (0)
Hoà tan 11,1g hỗn hợp 2 kim loại Al và Mg trong dd H2SO4 loãng dư ,thấy có 11,2 lít khí H2 bay ra ở điều kiện tiêu chuẩn a: viết PTHH B: tính thành phần trăm các khối lượng kim loại trong hỗn hợp C: nếu dẫn toàn bộ khí H2 sinh ra ở trên đi qua 16g bột Fe3oxit nóng thì khối lượng kim loại thứ được là bao nhiêu gam
a)
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$Mg + H_2SO_4 \to MgSO_4 + H_2$
b) Gọi $n_{Al} =a (mol) ; n_{Mg} = b(mol) \Rightarrow 27a + 24b = 11,1(1)$
Theo PTHH : $n_{H_2} = 1,5a + b = \dfrac{11,2}{22,4} = 0,5(2)$
Từ (1)(2) suy ra : a = 0,1 ; b = 0,35
$\%m_{Al} = \dfrac{0,1.27}{11,1}.100\% = 24,3\%$
$\%m_{Mg} = 100\% - 24,3\% = 75,7\%$
c) $n_{Fe_2O_3} = \dfrac{16}{160} = 0,1(mol)$
$Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O$
Ta thấy :
$n_{Fe_2O_3} : 1 < n_{H_2} : 3$ nên $H_2$ dư
$n_{Fe} = 2n_{Fe_2O_3} = 0,2(mol)$
$m_{Fe} = 0,2.56 = 11,2(gam)$
Đúng 1
Bình luận (0)