Cho hỗn hợp chứa 6,2 gam Na2O và 20,4 gam Al2O3 vào 500 gam H2O. Tính C% dung dịch sau phản ứng.

Những câu hỏi liên quan
Cho m gam hỗn hợp X gồm Na2O và Al2O3, vào nước dư, phản ứng xong thấy còn 2,04 gam chất rắn không tan. Mặt khác m gam X phản ứng vừa đủ với 520 ml dung dịch HCI 1M, thu được dung dịch chỉ chứa muối. Tính giá trị m.
PTHH: \(Na_2O+H_2O\rightarrow2NaOH\) (1)
\(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O\) (2)
\(NaAlO_2+4HCl\rightarrow NaCl+AlCl_3+2H_2O\) (3)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\) (4)
Ta có: \(\left\{{}\begin{matrix}n_{Al_2O_3\left(dư\right)}=\dfrac{2,04}{102}=0,02\left(mol\right)\\\Sigma n_{HCl}=0,52\cdot1=0,52\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\Sigma n_{Al_2O_3}=0,22\left(mol\right)\\n_{Na_2O}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{hh}=0,22\cdot102+0,2\cdot62=34,84\left(g\right)\)
Đúng 2
Bình luận (0)
Hoà tan 63,8 gam hỗn hợp BaCl2 và CaCl2 vào 500 gam H2O thu được dung dịch A. Thêm 500 ml dung dịch Na2CO3 1,4M vào dung dịch A, sau phản ứng thu được 59,4 gam kết tủa và dung dịch B.a. Trong dung dich B tồn tại những muối nào?b. Tính nồng độ % của mỗi muối trong dung dịch A.c. Thêm vào dung dịch B một lượng vừa đủ dung dịch HCl 0,5M (D1,05 g/ml) thu được dung dịch C. Tính thể tích dung dịch HCl 0,5M đã dùng và nồng độ % của muối trong dung dịch C. biết khối lượng riêng dung dịch Na2C...
Đọc tiếp
Hoà tan 63,8 gam hỗn hợp BaCl2 và CaCl2 vào 500 gam H2O thu được dung dịch A. Thêm 500 ml dung dịch Na2CO3 1,4M vào dung dịch A, sau phản ứng thu được 59,4 gam kết tủa và dung dịch B.
a. Trong dung dich B tồn tại những muối nào?
b. Tính nồng độ % của mỗi muối trong dung dịch A.
c. Thêm vào dung dịch B một lượng vừa đủ dung dịch HCl 0,5M (D=1,05 g/ml) thu được dung dịch C. Tính thể tích dung dịch HCl 0,5M đã dùng và nồng độ % của muối trong dung dịch C. biết khối lượng riêng dung dịch Na2CO3 là 1,64 g/ml
Hoà tan hoàn toàn 8,2 gam hỗn hợp Na2O, Al2O3 vào nước thu được dung dịch X chỉ chứa một chất tan duy nhất. Tính thể tích CO2 (đktc) cần để phản ứng hết với dung dịch X A. 1,12 lít B. 2,24 lít C. 4,48 lít D. 3,36 lít
Đọc tiếp
Hoà tan hoàn toàn 8,2 gam hỗn hợp Na2O, Al2O3 vào nước thu được dung dịch X chỉ chứa một chất tan duy nhất. Tính thể tích CO2 (đktc) cần để phản ứng hết với dung dịch X
A. 1,12 lít
B. 2,24 lít
C. 4,48 lít
D. 3,36 lít
Đáp án B
Chỉ thu được một chất tan nên số mol Na2O và Al2O3 bằng nhau
⇒ n N a 2 O = n A l 2 O 3 = 8 , 2 62 + 102 = 0 , 05
Chất tan trong X là 0,1 mol NaAl(OH)4
Thể tích CO2 cần dùng là: V=22,4 .0,1=2,24
Đúng 0
Bình luận (0)
Cho m gam hỗn hợp gồm Na2O và Al2O3 vào 400 ml dung dịch H2SO4 0,3M và HCl 0,9M. Sau khi kết thúc phản ứng, thu được dung dịch X. Cho dung dịch Ba(OH)2 dư vào X, phản ứng được biểu diễn theo đồ thị sau: Giá trị của m là A. 16,04 gam B. 17,20 gam C. 11,08 gam D. 9,84 gam.
Đọc tiếp
Cho m gam hỗn hợp gồm Na2O và Al2O3 vào 400 ml dung dịch H2SO4 0,3M và HCl 0,9M. Sau khi kết thúc phản ứng, thu được dung dịch X. Cho dung dịch Ba(OH)2 dư vào X, phản ứng được biểu diễn theo đồ thị sau:

Giá trị của m là
A. 16,04 gam
B. 17,20 gam
C. 11,08 gam
D. 9,84 gam.
Đáp án C
Cho hỗn hợp Na2O và Al2O3 vào 0,12 mol H2SO4 và 0,36 mol HCl thu được dung dịch X.
Cho Ba(OH)2 dư vào X ta thấy đồ thị như trên do vậy có các giai đoạn:
+Giai đoạn kết tủa tăng do tạo kết tủa BaSO4 và Al(OH)3.
+Kết tủa giảm do có sự hòa tan Al(OH)3.
+Kết tủa không đổi lúc này chỉ còn BaSO4.
Có n(H2SO4) = 0,12 (mol) và n(HCl) = 0,36 (mol)
→ n(BaSO4 max) = 0,12 mol và n(Al(OH)3 max) = 0,12 (mol)
Do kết tủa vẫn còn Al(OH)3 nên X phải có Al3+ → Dung dịch X không có OH- và AlO2-.
→ X có chứa Al3+ (0,12 mol); Na+ (a mol); H+ (b mol); Cl- (0,36 mol); SO42- (0,12 mol)
BT điện tích cho X: a + b = 0,12. 3 = 0,36 + 0,12. 2 (1)
Khi n(Ba(OH)2) = 0,28 mol hay n(OH-) = 0,56 mol thì Al(OH)3đã bị hòa tan hoàn toàn nên:
0,56 – b = 0,12. 4 → b = 0,08 → a = 0,16 mol
Vậy ban đầu n(Na2O) = a/2 = 0,08 mol và n(Al2O3) = 0,12 : 2 = 0,06 mol
→ m = 11,08 (g)
Đúng 0
Bình luận (0)
Cho m gam hỗn hợp gồm Na2O và Al2O3 vào 400 ml dung dịch H2SO4 0,3M và HCl 0,9M. Sau khi kết thúc phản ứng, thu được dung dịch X. Cho dung dịch Ba(OH)2 dư vào X, phản ứng được biểu diễn theo đồ thị sau: Giá trị của m là A. 16,04 gam B. 17,20 gam C. 11,08 gam D. 9,84 gam
Đọc tiếp
Cho m gam hỗn hợp gồm Na2O và Al2O3 vào 400 ml dung dịch H2SO4 0,3M và HCl 0,9M. Sau khi kết thúc phản ứng, thu được dung dịch X. Cho dung dịch Ba(OH)2 dư vào X, phản ứng được biểu diễn theo đồ thị sau:
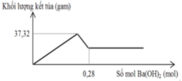
Giá trị của m là
A. 16,04 gam
B. 17,20 gam
C. 11,08 gam
D. 9,84 gam
Chọn C
Cho hỗn hợp Na2O và Al2O3 vào 0,12 mol H2SO4 và 0,36 mol HCl thu được dung dịch X.
Cho Ba(OH)2 dư vào X ta thấy đồ thị như trên do vậy có các giai đoạn:
+Giai đoạn kết tủa tăng do tạo kết tủa BaSO4 và Al(OH)3.
+Kết tủa giảm do có sự hòa tan Al(OH)3.
+Kết tủa không đổi lúc này chỉ còn BaSO4.
Có n(H2SO4) = 0,12 (mol) và n(HCl) = 0,36 (mol)
→ n(BaSO4 max) = 0,12 mol và n(Al(OH)3 max) = 0,12 (mol)
Do kết tủa vẫn còn Al(OH)3 nên X phải có Al3+ → Dung dịch X không có OH- và AlO2-.
→ X có chứa Al3+ (0,12 mol); Na+ (a mol); H+ (b mol); Cl- (0,36 mol); SO42- (0,12 mol)
BT điện tích cho X: a + b = 0,12. 3 = 0,36 + 0,12. 2 (1)
Khi n(Ba(OH)2) = 0,28 mol hay n(OH-) = 0,56 mol thì Al(OH)3đã bị hòa tan hoàn toàn nên:
0,56 – b = 0,12. 4 → b = 0,08 → a = 0,16 mol
Vậy ban đầu n(Na2O) = a/2 = 0,08 mol và n(Al2O3) = 0,12 : 2 = 0,06 mol
→ m = 11,08 (g)
Đúng 0
Bình luận (0)
Cho m gam hỗn hợp gồm Na2O và Al2O3 vào 400 ml dung dịch H2SO4 0,3M và HCl 0,9M. Sau khi kết thúc phản ứng, thu được dung dịch X. Cho dung dịch Ba(OH)2 dư vào X, phản ứng được biểu diễn theo đồ thị sau: Giá trị của m là A. 9,84 gam B. 17,20 gam. C. 16,04 gam. D. 11,08 gam.
Đọc tiếp
Cho m gam hỗn hợp gồm Na2O và Al2O3 vào 400 ml dung dịch H2SO4 0,3M và HCl 0,9M. Sau khi kết thúc phản ứng, thu được dung dịch X. Cho dung dịch Ba(OH)2 dư vào X, phản ứng được biểu diễn theo đồ thị sau:
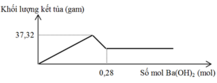
Giá trị của m là
A. 9,84 gam
B. 17,20 gam.
C. 16,04 gam.
D. 11,08 gam.
Đáp án D
Cho hỗn hợp Na2O và Al2O3 vào 0,12 mol H2SO4 và 0,36 mol HCl thu được dung dịch X.
Cho Ba(OH)2 dư vào X ta thấy đồ thị như trên do vậy có các giai đoạn:
+Giai đoạn kết tủa tăng do tạo kết tủa BaSO4 và Al(OH)3.
+Kết tủa giảm do có sự hòa tan Al(OH)3.
+Kết tủa không đổi lúc này chỉ còn BaSO4.
Gọi số mol Na2O và Al2O3 lần lượt là a, b.
Kết tủa cực đại chứa BaSO4 0,12 mol và Al(OH)3
→ n A l ( O H ) 3 = 0 , 12 m o l → b = 0 , 06 m o l ⇒ 0 , 28 . 2 + 2 a - 0 , 12 - 0 , 12 . 2 - 0 , 36 = 0 → a = 0 , 08 m o l → m = 11 , 08 g a m
Đúng 0
Bình luận (0)
Cho m gam hỗn hợp gồm Na2O và Al2O3 vào 400 ml dung dịch H2SO4 0,3M và HCl 0,9M. Sau khi kết thúc phản ứng, thu được dung dịch X. Cho dung dịch Ba(OH)2 dư vào X, phản ứng được biểu diễn theo đồ thị sau: Giá trị của m là A. 9,84 gam. B. 17,20 gam. C. 16,04 gam. D. 11,08 gam.
Đọc tiếp
Cho m gam hỗn hợp gồm Na2O và Al2O3 vào 400 ml dung dịch H2SO4 0,3M và HCl 0,9M. Sau khi kết thúc phản ứng, thu được dung dịch X. Cho dung dịch Ba(OH)2 dư vào X, phản ứng được biểu diễn theo đồ thị sau:

Giá trị của m là
A. 9,84 gam.
B. 17,20 gam.
C. 16,04 gam.
D. 11,08 gam.
Đáp án D
Cho hỗn hợp Na2O và Al2O3 vào 0,12 mol H2SO4 và 0,36 mol HCl thu được dung dịch X.
Cho Ba(OH)2 dư vào X ta thấy đồ thị như trên do vậy có các giai đoạn:
+Giai đoạn kết tủa tăng do tạo kết tủa BaSO4 và Al(OH)3.
+Kết tủa giảm do có sự hòa tan Al(OH)3.
+Kết tủa không đổi lúc này chỉ còn BaSO4.
Gọi số mol Na2O và Al2O3 lần lượt là a, b.
Kết tủa cực đại chứa BaSO4 0,12 mol và Al(OH)3
n A l ( O H ) 3 = 0 , 12 m o l => b = 0,06 mol
Suy ra: 0,28.2 + 2a - 0,12 - 0,12.2 - 0,36 = 0 => a = 0,08 mol
=> m = 11,08 gam
Đúng 0
Bình luận (0)
Hòa tan 6,2 Na2O vào 91,25 gam dung dịch có chứa HCl 10%. Viết PTHH . Tính khối lượng muối ăn sau phản ứng. Xác định nồng độ phần trăm của dung dịch sau phản ứng
\(n_{Na_2O}=\dfrac{6.2}{62}=0.1\left(mol\right)\)
\(n_{HCl}=\dfrac{91.25\cdot10\%}{36.5}=0.25\left(mol\right)\)
\(Na_2O+2HCl\rightarrow2NaCl+H_2O\)
\(TC:\dfrac{0.1}{1}< \dfrac{0.25}{2}\Rightarrow HCldư\)
\(m_{NaCl}=0.1\cdot2\cdot58.5=11.7\left(g\right)\)
\(m_{dd}=6.2+91.25=97.45\left(g\right)\)
\(C\%_{NaCl}=\dfrac{11.7}{97.45}\cdot100\%=12\%\)
\(C\%_{HCl\left(dư\right)}=\dfrac{\left(0.25-0.2\right)\cdot36.5}{97.45}\cdot100\%=1.87\%\)
Đúng 1
Bình luận (2)
nNa2O=0,1(mol)
PTHH: Na2O + H2O -> 2 NaOH
-> nNaOH=0,2(mol)
nHCl=9,125(mol)->nHCl=0,25(mol)
PTHH: NaOH + HCl -> NaCl + H2O
Vì 0,25/1 > 0,2/1
=> NaOH hết, HCl dư, tính theo nNaOH
-> nNaCl=nHCl(p.ứ)=nNaOH=0,2(mol)
=>mNaCl=58,5.0,2= 11,7(g)
mHCl(dư)=0,05.36,5= 1,825(g)
mddsau=0,2.40+ 91,25= 99,25(g)
=>C%ddHCl(dư)=(1,825/99,25).100=1,839%
C%ddNaCl=(11,7/99,25).100=11,788%
Đúng 1
Bình luận (0)
Cho 10 gam hỗn hợp CuO và Na2O vào nước dư thu được 3,8
gam chất rắn và 200 gam dung dịch. Tính khối lượng chất tan và C%
dung dịch thu được sau phản ứng.
Giúp vs, mình đg cần gấp!!!
a)
$m_{CuO} = 3,8(gam) \Rightarrow m_{Na_2O} = 10 - 3,8 = 6,2(gam)$
$n_{Na_2O} = \dfrac{6,2}{62} = 0,1(mol)$
$Na_2O + H_2O \to 2NaOH$
$n_{NaOH} = 2n_{Na_2O} = 0,2(mol)$
$m_{NaOH} = 0,2.40 = 8(gam)$
$C\%_{NaOH} = \dfrac{8}{200}.100\% = 4\%$
Đúng 1
Bình luận (1)













