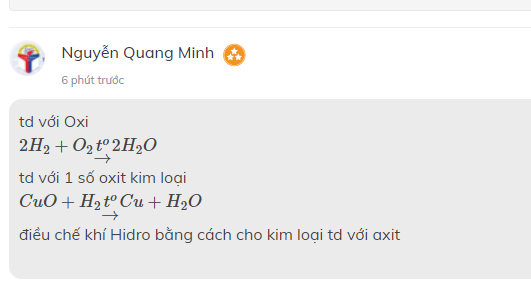
Nêu tính chất hoá học, nguyên liệu điều chế hidro trong phòng thí nghiệm. Viết PTHH minh hoạ.

Những câu hỏi liên quan
Nêu tính chất hoá học, nguyên liệu điều chế hidro trong phòng thí nghiệm. Viết PTHH minh hoạ.
a) Nêu tính chất hóa học của oxi , hidro . mỗi tính chất cho 2 puhh minh họa
b) Nêu nguyên liệu , viết pthh điều chế khí o2 , h2 trong phòng thí nghiệm
giúp e với ạ ,e cảm ơn
a) bạn tự học SGK
b) Nguyên liệu điều chế O2: KMnO4, KClO3, KNO3 (độc), H2O,...
2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
2KClO3 -> (t°, MnO2) 2KCl + 3O2
2KNO3 -> (t°) 2KNO2 + O2
2H2O -> (đp) 2H2 + O2
Nguyên liệu điều chế H2: Pb, Zn, Fe, Al, HCl, H2SO4 loãng,...
Fe + 2HCl -> FeCl2 + H2
2Al + 3H2SO4 ->
Al2(SO4)3 + 3H2
2H2O -> (đp) 2H2 + O2
Đúng 5
Bình luận (0)
Nêu nguyên liệu dùng để điều chế oxi, hidro trong phòng thí nghiệm. Viết pthh minh họa? Nguyên liệu dùng để điều chế oxi trong phòng thí nghiệm phải có đặc điểm gì? Không khí có thành phần như thế nào? Có thể thu khí oxi và hidro bằng những cách nào, tại sao?
Đọc tiếp
Nêu nguyên liệu dùng để điều chế oxi, hidro trong phòng thí nghiệm. Viết pthh minh họa? Nguyên liệu dùng để điều chế oxi trong phòng thí nghiệm phải có đặc điểm gì? Không khí có thành phần như thế nào? Có thể thu khí oxi và hidro bằng những cách nào, tại sao?
Nêu nguyên tắc của việc điều chế khí Cl2 trong phòng thí nghiệm. Viết PTHH của 5 phản ứng minh hoạ.
Cho chất oxi hoá mạnh tác dụng với dung dịch HCl đặc (từng chất oxi hoá mạnh để oxi hoá ion clorua Cl - thành đơn chất clo).
Mn O 2 + 4HCl → Mn Cl 2 + Cl 2 + 2 H 2 O
2KMn O 4 + 16HCl → 2KCl + 2Mn Cl 2 + 5 Cl 2 + 8 H 2 O
KCl O 3 + 6HCl → KCl + 3 Cl 2 + 3 H 2 O
CaO Cl 2 + 2HCl → Ca Cl 2 + Cl 2 + H 2 O
K 2 Cr 2 O 7 + 14HCl → 2KCl + 2Cr Cl 3 + 3 Cl 2 + 7 H 2 O
Đúng 0
Bình luận (0)
Nêu tính chất vật lí, tính chất hóa học, ứng dụng, điều chế khí oxi và khí hidro trong phòng thí nghiệm.
1. Nêu tính chất hóa học của oxi, hiđro. Viết phương trình hóa học minh họa.
2. Viết PTHH để điều chế H2, O2 trong phòng thí nghiệm.
3. Nêu khái niệm, cách gọi tên, phân loại oxit. Lấy ví dụ minh họa.
4. Nêu tên, khái niệm, ví dụ về các loại phản ứng hóa học đã học.
5. Nêu ứng dụng của oxi, hiđro.
Viết các PTHH điều chế oxi và hidro trong phòng thí nghiệm
Điều chế Hidro :
\(Mg + 2HCl \to MgCl_2 + H_2\\ Fe + 2H_2SO_4 \to FeSO_4 + H_2\)
Điều chế oxi :
\(2KNO_3 \xrightarrow{t^o} 2KNO_2 + O_2\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_2 + MnO_2 + O_2\)
Đúng 4
Bình luận (0)
Điều chế khí H2:
Al + HCl ---> AlCl3 + H2.
Al + H2SO4 ---> Al2(SO4)3 + H2.
Zn + HCl ---> ZnCl2 + H2.
Zn + H2SO4 ---> ZnSO4 + H2.
Fe + HCl ---> FeCl2 + H2.
Fe + H2SO4 ---> FeSO4 + H2.
Điều chế khí O2:
2KMnO4 ---to---> K2MnO4 + MnO2 + O2.
2KClO3 ---to---> 2KCl + 3O2.
2KNO3 ---to---> KNO2 + O2.
Đúng 0
Bình luận (0)
1a. Vì sao hidro được coi là nhiên liệu sạch. b. viết các phương trình hóa học điều chế hidro trong phòng thí nghiệm và trong công nghiệp?
a) Khi đốt cháy hidro sinh ra phản ứng
\(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\)
Đây là phản ứng tỏa nhiều nhiệt, nước sinh ra vô hại. Do đó, hidro được coi là nguyên liệu sạch
b)
Trong phòng thí nghiệm :
\(Mg + 2HCl \to MgCl_2 + H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\)
Trong công nghiệp :
\(2H_2O \xrightarrow{điện\ phân} 2H_2 + O_2\)
Đúng 1
Bình luận (0)
a. H2 là nhiên liệu sạch vì khi đốt không thải ra khí hại mà tạo ra hơi nước (cần thiết cho môi trường)
b. Điều chế H2:
*Trong phòng thí nghiệm: Cho 1 số kim loại (ví dụ Zn, Fe, Mg, ...) tác dụng với axit (HCl, H2SO4, ...)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
*Trong công nghiệp: Điện phân nước: \(2H_2O\underrightarrow{\text{điện phân}}2H_2+O_2\)
Đúng 1
Bình luận (0)
Nêu tính chất vật lý, tính chất hoá học, ứng dụng và điều chế oxi. (viết phương trình hóa học minh hoạ
vật lý : là một chất không có mùi, không có màu sắc, không có vị. Oxi tan ít trong nước và có khối lượng nặng hơn không khí. Khi chịu áp suất của khí quyển thì oxi sẽ hóa lỏng ở -183 độ. Khi hóa lỏng sẽ có màu xanh nhạt.
hóa học
td với phi kim :
S+O2 -to-> SO2
td với Kim loại
2Zn + O2 -to -> 2ZnO
td với h/c
CH4 +2O2 -to-> CO2 +2H2O
ứng dụng : Oxi cần cho sự hộ hấ của con người và động vật , cần để đốt nhiên liệu trogn đời sống và sản suất
điều chế khí O2 bằng những chất dễ phân hủy và giàu oxii
Đúng 0
Bình luận (0)