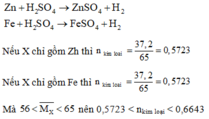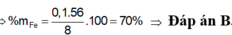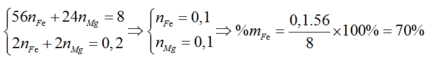Bài 5: Hòa tan hoàn toàn 16,2g hỗn hợp X gồm Zn và ZnS vào dung dịch h2so4 loãng dư, thu được dung dịch Y và 4,48 lít hỗn hợp khí Z (đo ở đktc) a. Tính % theo khối lượng mỗi chất trong hỗn hợp Xb. Nếu dẫn toàn bộ hỗn hợp khí Z vào dung dịch Pb(no3)2 dư đến phản ứng hoàn toàn thì thu được bao nhiêu gam kết tủac. Nếu đem đốt cháy hoàn toàn hỗn hợp khí Z bằng oxi rồi hấp thụ sản phẩm cháy vào 100ml dung dịch NaOH 1,5M thì thu được những muối nào ? khối lượng là bao nhiêu gam?Bài 6: Hòa tan hoàn toà...
Đọc tiếp
Bài 5: Hòa tan hoàn toàn 16,2g hỗn hợp X gồm Zn và ZnS vào dung dịch h2so4 loãng dư, thu được dung dịch Y và 4,48 lít hỗn hợp khí Z (đo ở đktc)
a. Tính % theo khối lượng mỗi chất trong hỗn hợp X
b. Nếu dẫn toàn bộ hỗn hợp khí Z vào dung dịch Pb(no3)2 dư đến phản ứng hoàn toàn thì thu được bao nhiêu gam kết tủa
c. Nếu đem đốt cháy hoàn toàn hỗn hợp khí Z bằng oxi rồi hấp thụ sản phẩm cháy vào 100ml dung dịch NaOH 1,5M thì thu được những muối nào ? khối lượng là bao nhiêu gam?
Bài 6: Hòa tan hoàn toàn 17,6g hỗn hợp X gồm Cu và Fe bằng lượng dư dung dịch h2so4 đặc nóng, thu được dung dịch Y và 8,96 lít khí So2 (sản phẩm khử duy nhất, đo ở đktc)
a. Tính % theo khối lượng mỗi kim loai trong hỗn hợp X
b. Nếu đem 22g hỗn hợp X nói trên cho tác dụng với lượng dư dung dịch h2so4 loãng thì thể tích khí thu được (đo ở đktc) là bao nhiêu lít (giả sử hỗn hợp X được trộn đều)
mong mn giúp đỡ ạ