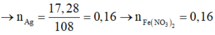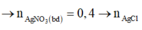Cho 100 ml dung dịch MgCl2 1M phản ứng với 100 ml dung dịch AgNO3 0,8M thu được m gam kết tủa và 200 ml dung dịch X. Tính m và nồng độ mol mỗi chất tan trong X.

Những câu hỏi liên quan
Trộn 400 ml dung dịch NaOH 1M với 100 ml dung dịch FeCl3 1M thu được m gam kết tủa và dung
dịch X.
1.Viết phương trình phản ứng? Tính m?
2.Tính nồng độ mol của mỗi chất trong dung dịch X?
\(n_{NaOH}=1.0,4=0,4(mol);n_{FeCl_3}=1.0,1=0,1(mol)\\ a,PTHH:3NaOH+FeCl_3\to Fe(OH)_3\downarrow+3NaCl\\ \text {Vì }\dfrac{n_{NaOH}}{3}>\dfrac{n_{FeCl_3}}{1} \text {nên }NaOH\text { dư}\\ \Rightarrow n_{Fe(OH)_3}=0,1(mol)\\ \Rightarrow m_{Fe(OH)_3}=107.0,1=10,7(g)\\ b,n_{NaCl}=3n_{FeCl_3}=0,3(mol)\\ \Rightarrow C_{M_{NaCl}}=\dfrac{0,3}{0,4+0,1}=0,6M\)
Đúng 1
Bình luận (1)
Bài 2. Cho 500 mL dung dịch X chứa FeCl3 và MgCl2 tác dụng vừa đủ với 200 mL dung dịch KOH 2,5M, sau phản ứng thu được 16,5 gam kết tủa. Tính nồng độ mol của các chất tan trong dung dịch X.
Gọi: \(\left\{{}\begin{matrix}n_{FeCl_3}=x\left(mol\right)\\n_{MgCl_2}=y\left(mol\right)\end{matrix}\right.\)
PT: \(FeCl_3+3KOH\rightarrow Fe\left(OH\right)_{3\downarrow}+3KCl\)
______x_________3x_________x (mol)
\(MgCl_2+2KOH\rightarrow Mg\left(OH\right)_{2\downarrow}+2KCl\)
____y_________2y_________y (mol)
Ta có: \(n_{KOH}=0,2.2,5=0,5\left(mol\right)\)
⇒ 3x + 2y = 0,5 (1)
m kết tủa = 16,5 ⇒ 107x + 58y = 16,5 (2)
Từ (1) và (2) ⇒ x = y = 0,1 (mol)
\(\Rightarrow C_{M_{FeCl_3}}=C_{M_{MgCl_2}}=\dfrac{0,1}{0,5}=0,2\left(M\right)\)
Đúng 3
Bình luận (0)
\(FeCl_3+3KOH\rightarrow Fe\left(OH\right)_3\downarrow+3KCl\\ MgCl_2+2KOH\rightarrow Mg\left(OH\right)_2\downarrow+2KCl\)
\(n_{KOH}=0,2\cdot2,5=0,5\left(mol\right)\)
Đặt nFeCl₃ trong 500ml X là a mol, nMgCl₂ trong 500ml X là b mol
\(\Rightarrow\left\{{}\begin{matrix}3a+2b=0,5\\107a+58b=16,5\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow C_MFeCl_3=\dfrac{0,1}{0,5}=0,2\left(M\right)\\ C_MMgCl_2=\dfrac{0,1}{0,5}=0,2\left(M\right)\)
Đúng 1
Bình luận (0)
Cho 500 ml dung dịch NaOH 1M phản ứng vừa đủ với 500 ml dung dịch MgSO4 thu được m gam kết tủa và dung dịch X. a) Viết PTHH xảy ra. b) Tính khối lượng chất kết tủa thu được. c) Tính nồng độ mol chất tan trong dung dịch X. Giả sử thể tích dung dịch sau phản ứng thay đổi không đáng kể
\(a,2NaOH+MgSO_4\rightarrow Mg\left(OH\right)_2+Na_2SO_4\\ n_{NaOH}=0,5.1=0,5\left(mol\right)\\ b,n_{Mg\left(OH\right)_2}=\dfrac{0,5}{2}=0,25\left(mol\right)=n_{Na_2SO_4}\\ m_{kt}=m_{Mg\left(OH\right)_2}=58.0,25=14,5\left(g\right)\\ c,V_{ddX}=V_{ddNaOH}+V_{ddMgSO_4}=0,5+0,5=1\left(l\right)\\ C_{MddNa_2SO_4}=\dfrac{0,25}{1}=0,25\left(M\right)\)
Đúng 2
Bình luận (0)
Trộn 200 ml dung dịch AgNO3 0,25M với 300 ml dung dịch MgCl2 0,1M thu được dung dịch X và a
gam kết tủa Y.
1.Viết PTPU và tính a ?
2.Tính nồng độ mol của mỗi chất trong dung dịch X ?
giúp tớ với huhu
\(n_{AgNO_3}=0,25\cdot0,2=0,05\left(mol\right);n_{MgCl_2}=0,1\cdot0,3=0,03\left(mol\right)\\ a,PTHH:2AgNO_3+MgCl_2\rightarrow2AgCl\downarrow+Mg\left(NO_3\right)_2\\ \text{Vì }\dfrac{n_{AgNO_3}}{2}< \dfrac{n_{MgCl_2}}{1}\text{ nên sau phản ứng }MgCl_2\text{ dư}\\ \Rightarrow n_{AgCl}=n_{AgNO_3}=0,05\left(mol\right)\\ \Rightarrow a=m_{AgCl}=0,05\cdot143,5=7,175\left(g\right)\\ 2,n_{Mg\left(NO_3\right)_2}=\dfrac{1}{2}n_{AgNO_3}=0,025\left(mol\right)\\ \Rightarrow C_{M_{Mg\left(NO_3\right)_2}}=\dfrac{0,025}{0,2+0,3}=0,05M\)
Đúng 1
Bình luận (0)
Đáp án:
CÂU 3:
1)1) PTHH: 2AgNO3+MgCl2→2AgCl↓+Mg(NO3)22AgNO3+MgCl2→2AgCl↓+Mg(NO3)2
nAgNO3=0,2×0,25=0,05(mol)nAgNO3=0,2×0,25=0,05(mol)
nMgCl2=0,3×0,1=0,03(mol)nMgCl2=0,3×0,1=0,03(mol)
Xét nMgCl21nMgCl21
→ AgNO3AgNO3 hết, MgCl2MgCl2 dư.
Tính theo số mol AgNO3AgNO3
→ nMg(NO3)2=12×0,05=0,025(mol)nMg(NO3)2=12×0,05=0,025(mol)
⇒ a=mAgCl=0,05×143,5=7,175(g)a=mAgCl=0,05×143,5=7,175(g)
b)b) - Dung dịch aa gồm: MgCl2MgCl2 dư và Mg(NO3)2Mg(NO3)2
Xem như thể tích dung dịch sau phản ứng thay đổi không đáng kể.
→ Vdd=0,2+0,3=0,5(l)Vdd=0,2+0,3=0,5(l)
⇒ C(M)Mg(NO3)2=0,0250,5=0,05(M)
Đúng 0
Bình luận (0)
1. Lấy 150 ml dung dịch CaCl, tác dụng vừa đủ với 50 ml dung dịch AgNO3, sau phản ứng thu được 28,7 gam kết tủa và dung dịch X. Giả sử thể tích dung dịch sau phản ứng thay đổi không đáng kể thì nồng độ mol/lit của chất tan trong dung dịch X bằng?2. Một cốc chứa 500 ml nước và lá nhôm khối lượng 5,4 gam, cho thêm vào cốc 2,3 gam kim loại natri. Sau khi kết thúc phản ứng, thu được V lít khí (đktc), dung dịch X có chứa m gam chất tan và một lượng chất rắn chưa tan. Giá trị của V và m lần lượt?
Đọc tiếp
1. Lấy 150 ml dung dịch CaCl, tác dụng vừa đủ với 50 ml dung dịch AgNO3, sau phản ứng thu được 28,7 gam kết tủa và dung dịch X. Giả sử thể tích dung dịch sau phản ứng thay đổi không đáng kể thì nồng độ mol/lit của chất tan trong dung dịch X bằng?
2. Một cốc chứa 500 ml nước và lá nhôm khối lượng 5,4 gam, cho thêm vào cốc 2,3 gam kim loại natri. Sau khi kết thúc phản ứng, thu được V lít khí (đktc), dung dịch X có chứa m gam chất tan và một lượng chất rắn chưa tan. Giá trị của V và m lần lượt?
1. \(CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgCl_{\downarrow}\)
\(n_{AgCl}=\dfrac{28,7}{143,5}=0,2\left(mol\right)\)
Theo PT: \(n_{Ca\left(NO_3\right)_2}=\dfrac{1}{2}n_{AgCl}=0,1\left(mol\right)\)
\(\Rightarrow C_{M_{Ca\left(NO_3\right)_2}}=\dfrac{0,1}{0,15+0,05}=0,5\left(M\right)\)
Đúng 2
Bình luận (0)
2. \(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)\)
BTNT Na, có: nNaOH = nNa = 0,1 (mol)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2\)
Xét tỉ lệ \(\dfrac{0,2}{2}>\dfrac{0,1}{2}\), ta được Al dư.
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{NaOH}=0,15\left(mol\right)\Rightarrow V_{H_2}=0,15.22,4=3,36\left(l\right)\)
\(n_{Al\left(pư\right)}=n_{NaOH}=0,1\left(mol\right)\Rightarrow n_{Al\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)
\(\Rightarrow m_{Al\left(dư\right)}=0,1.27=2,7\left(g\right)\)
Đúng 2
Bình luận (0)
Có 500 ml dung dịch X chứa các ion K+; Cl- và Ba2+. Lấy 100 ml dung dịch X phản ứng với dung dịch NaOH dư, kết thúc các phản ứng thu được 19,7 gam kết tủa. Lấy 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, sau khi các phản ứng kết thúc thu được 29,55 gam kết tủa. Cho 200 ml dung dịch X phản ứng với lượng dư dung dịch AgNO3, kết thúc phản ứng thu được 28,7 gam kết tủa. Mặt khác, nếu đun sôi đến cạn 50 ml dung dịch X thì khối lượng chất rắn khan thu được là A. 23,700 gam B. 14,175 gam C....
Đọc tiếp
Có 500 ml dung dịch X chứa các ion K+; Cl- và Ba2+. Lấy 100 ml dung dịch X phản ứng với dung dịch NaOH dư, kết thúc các phản ứng thu được 19,7 gam kết tủa. Lấy 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, sau khi các phản ứng kết thúc thu được 29,55 gam kết tủa. Cho 200 ml dung dịch X phản ứng với lượng dư dung dịch AgNO3, kết thúc phản ứng thu được 28,7 gam kết tủa. Mặt khác, nếu đun sôi đến cạn 50 ml dung dịch X thì khối lượng chất rắn khan thu được là
A. 23,700 gam
B. 14,175 gam
C. 11,850 gam
D. 10,062 gam
Đáp án C
Trong 100ml dd X có 0,1 mol Ba2+, 0,15 mol .
Trong 200ml dung dịch X có 0,2 mol Cl-.
Do đó trong 50 ml dung dịch X có 0,05 mol Ba2+, 0,075 mol , 0,05 mol Cl- và x mol K+
Theo định luật bảo toàn điện tích được x = 0,025
Khi cô cạn xảy ra quá trình:

Đúng 0
Bình luận (0)
Có 500 ml dung dịch X chứa các ion: K+, HCO3-, Cl- và Ba2+. Lấy 100 ml dung dịch X phản ứng với dung dịch NaOH dư, kết thúc các phản ứng thu được 19,7 gam kết tủa. Lấy 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, sau khi các phản ứng kết thúc thu được 29,55 gam kết tủa. Cho 200 ml dung dịch X phản ứng với lượng dư dung dịch AgNO3, kết thúc phản ứng thu được 28,7 gam kết tủa. Mặt khác, nếu đun sôi đến cạn 50 ml dung dịch X thì khối lượng chất rắn khan thu được là A. 23,700 g. B. 14,17...
Đọc tiếp
Có 500 ml dung dịch X chứa các ion: K+, HCO3-, Cl- và Ba2+. Lấy 100 ml dung dịch X phản ứng với dung dịch NaOH dư, kết thúc các phản ứng thu được 19,7 gam kết tủa. Lấy 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, sau khi các phản ứng kết thúc thu được 29,55 gam kết tủa. Cho 200 ml dung dịch X phản ứng với lượng dư dung dịch AgNO3, kết thúc phản ứng thu được 28,7 gam kết tủa. Mặt khác, nếu đun sôi đến cạn 50 ml dung dịch X thì khối lượng chất rắn khan thu được là
A. 23,700 g.
B. 14,175 g.
C. 11,850 g.
D. 10,062 g.
Trong 100ml dung dịch X có 0,1 mol Ba2+, 0,15 mol HCO3-
Trong 200ml dung dịch X có 0,2 mol Cl-
Do đó trong 50ml dung dịch X có 0,05 mol Ba2+, 0,075 mol HCO3- , 0,05 mol Cl- và x mol K+.
Theo định luật bảo toàn điện tích được x = 0,025.
Khi cô cạn xảy ra quá trình: 2HCO3- ⟶ CO32- + CO2 + H2O
Do đó: n C O 3 2 - = 0 , 0375
Vậy khối lượng chất rắn khan thu được là: m K + + m B a 2 + + m C O 3 2 - + m C l - = 11 , 85 ( g a m )
Đáp án C
Đúng 0
Bình luận (0)
Có 500 ml dung dịch X chứa các ion: K+,
H
C
O
3
-
,Cl – và Ba2+ . Lấy 100 ml dung dịch X phản ứng với dung dịch NaOH dư, kết thúc các phản ứng thu được 19,7 gamkết tủa. Lấy 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, sau khi các phản ứng kết thúc thu được 29,55 gam kết tủa . Cho 200 ml dung dịch X phản ứng với lượng dư dung dịch AgNO3, kết thúc phản ứng thu được 28,7 gam kết tủa. Mặt khác, nếu đun sôi đến cạn 50...
Đọc tiếp
Có 500 ml dung dịch X chứa các ion: K+, H C O 3 - ,Cl – và Ba2+ . Lấy 100 ml dung dịch X phản ứng với dung dịch NaOH dư, kết thúc các phản ứng thu được 19,7 gamkết tủa. Lấy 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, sau khi các phản ứng kết thúc thu được 29,55 gam kết tủa . Cho 200 ml dung dịch X phản ứng với lượng dư dung dịch AgNO3, kết thúc phản ứng thu được 28,7 gam kết tủa. Mặt khác, nếu đun sôi đến cạn 50 ml dung dịch X thì khối lượng chất rắn khan thu được là
A. 23,700 gam.
B. 14,175 gam.
C. 11,850gam
D. 10,062 gam.
Đáp án C
+ Lấy 100 ml dung dịch X phản ứng với dung dịch NaOH dư, kết thúc các phản ứng thu được 19,7 gam kết tủa⇒ n BaCO3 = n Ba2+ 0,1 mol . Lấy 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, sau khi các phản ứng kết thúc thu được 29,55 gam kết tủa
⇒ n BaCO3- = n HCO3- = 0,15 mol
⇒ Trong 100ml ddX có 0,1 mol Ba2+ , 0,15 mol HCO3- .
+ Cho 200 ml dung dịch X phản ứng với lượng dư dung dịch AgNO3, kết thúc phản ứng thu được 28,7 gam kết tủa ⇒ Trong 200ml ddX có nCl- = n AgCl = 0,2 mol
⇒ Trong 50ml ddX có 0,05 mol Ba2+ ; 0,075 mol HCO3- , 0,05 mol Cl- ⇒ nK+ = 0,025
2HCO3- → CO32- + CO2 + H2O
0,075 → 0,0375 0,0375(mol)
Khi đun sôi đến cạn: mkhan = m HCO3- + m Ba2+ + m K+ + m Cl- - m CO2 – m H2O
= 0,05.137 + 0,075.61 + 0,05.35,5 + 0,025.39 – 0,0375.44 - 0,0375.18 = 11,85g
Đúng 0
Bình luận (0)
Cho 200 ml dung dịch AgNO3 2,5a mol/l tác dụng với 200 ml dung dịch Fe(NO3)2 a mol/l. Sau khi phản ứng kết thúc thu được 17,28 gam chất rắn và dung dịch X. Cho dung dịch HCl dư vào dung dịch X thu được m gam kết tủa. Giá trị của m là
A. 34,44
B. 28,7
C. 40,18
D. 43,05