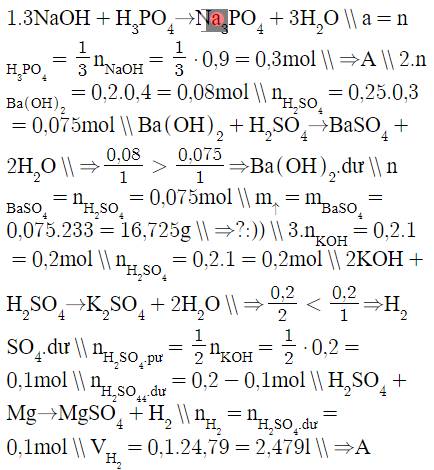dung dich H2SO4 0,4M có V=250ml. Tính m H2SO4 có trong dung dịch

Những câu hỏi liên quan
Trộn 250ml dung dịch Ba(OH)2 vào 0.5ml dung dịch H2SO4 1M thu được dung dịch Y. Tìm nồng độ mol/lít các ion có trong dung dich Y
Cho 250ml dung dịch Ba(OH)2 0,4M vào 250ml dung dịch H2SO4 0,3M. Nồng độ mol của chất trong dung dịch sau phản ứng
A. 0,05M B.0,15M C.0,2M D.0,025M
Cho 200ml dung dịch Ba(O
H
)
2
0,4M vào 250ml dung dịch
H
2
S
O
4
0,3M. Khối lượng kết tủa thu được là: A. 17,645 gam B. 16,475 gam C. 17,475 gam D. 18,645 gam
Đọc tiếp
Cho 200ml dung dịch Ba(O H ) 2 0,4M vào 250ml dung dịch H 2 S O 4 0,3M. Khối lượng kết tủa thu được là:
A. 17,645 gam
B. 16,475 gam
C. 17,475 gam
D. 18,645 gam
Chọn C

K ế t t ủ a l à B a S O 4 → n ↓ = n H 2 S O 4 = 0 , 075 m o l m ↓ = 0 , 075 . 233 = 17 , 475 g a m .
Đúng 0
Bình luận (0)
Cho 5,54g hỗn hợp gồm Al và Fe tác dụng với dung dịch H2SO4 20% thu được 3,584 lít khí H2 (đktc) a. Tính m mỗi kim loại trong hỗn hợp b. tính m H2SO4 phản ứng c. Tính m dung dịch H2SO4 phản ứng d. Dung dịch H2SO4 dư tác dụng với 250ml dd NaOH 0,6M. Tính m H2SO4 ban đầu. Thank you and love you so much!
help me
Bài 1: Tính nồng độ ban đầu của dung dich H2SO4 và dung dịch NaOH biết rằng:
-Nếu đổ 3 lít dung dịch NaOH vao 2 lít dung dịch H2SO4 thì sau phản ứng dung dich có tính kiềm với nồng độ 0,1M
-nếu đổ 2 lít dung dịch NaOH vào 3 lít dung dịch H2SO4 thì sau phản ứng dung dịch có tính axit với nồng độ 0,2M
Gọi CM H2SO4 = a là M. CMNaOH = b là M
- Nếu đổ 3 lít dung dịch NaOH vào 2 lít dung dịch H2SO4 thì khau khi phản ứng dung dịch có tính kiềm với nồng độ 0,1M
=> 3.b - 2.2a = 0,1.(2+3) =0,5
- Nếu đổ 2 lít dung dịch NaOH vào 3 lít dung dịch H2SO4 thì khau khi phản ứng dung dịch có tính axit với nồng độ 0,2M
=> 3.2.a-2b = 5.0,2 = 1
=> a=0,4
b = 0,7
Đúng 0
Bình luận (2)
250ml dung dịch có hòa tan 0,1 mol H2SO4. Hãy tính nồng độ mol của dung dịch axit
\(C_{M_{H_2SO_4}}=\dfrac{n}{V}=\dfrac{0,1}{0,25}=0,4M\)
Đúng 1
Bình luận (0)
1.Cho dung dịch chứa 0,9 mol NaOH vào dung dịch có chứa a mol H3PO4. Sau phản ứng chỉ thu được muối Na3PO4 và H2O. Giá trị của a là:A. 0,3 mol B. 0,4 mol C. 0,6 mol D. 0,9 mol 2. Cho 200ml dung dịch Ba(OH)2 0,4M vào 250ml dung dịch H2SO4 0,3M. Khối lượng kết tủa thu được là:A. 17,645 g B. 16,475 g C. 17,475 g D. 18,645 g 3.Cho 200ml dung dịch KOH 1M tác dụng với 200ml dung dịch H2SO4 1M, sau phản ứng cho thêm một mảnh Mg dư vào sản phẩm thấy thoát ra một thể tích khí H2 (đktc) là:A. 2...
Đọc tiếp
1.Cho dung dịch chứa 0,9 mol NaOH vào dung dịch có chứa a mol H3PO4. Sau phản ứng chỉ thu được muối Na3PO4 và H2O. Giá trị của a là:
A. 0,3 mol B. 0,4 mol C. 0,6 mol D. 0,9 mol 2. Cho 200ml dung dịch Ba(OH)2 0,4M vào 250ml dung dịch H2SO4 0,3M. Khối lượng kết tủa thu được là:
A. 17,645 g B. 16,475 g C. 17,475 g D. 18,645 g 3.Cho 200ml dung dịch KOH 1M tác dụng với 200ml dung dịch H2SO4 1M, sau phản ứng cho thêm một mảnh Mg dư vào sản phẩm thấy thoát ra một thể tích khí H2 (đktc) là:
A. 2,479 lít B. 4,958 lít C. 3,719 lít D. 7,437 lít
\(1.3NaOH+H_3PO_4\rightarrow Na_3PO_4+3H_2O\\ a=n_{H_3PO_4}=\dfrac{1}{3}n_{NaOH}=\dfrac{1}{3}\cdot0,9=0,3mol\\ \Rightarrow A\\ 2.n_{Ba\left(OH\right)_2}=0,2.0,4=0,08mol\\ n_{H_2SO_4}=0,25.0,3=0,075mol\\ Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\\ \Rightarrow\dfrac{0,08}{1}>\dfrac{0,075}{1}\Rightarrow Ba\left(OH\right)_2.dư\\ n_{BaSO_4}=n_{H_2SO_4}=0,075mol\\ m_{\uparrow}=m_{BaSO_4}=0,075.233=16,725g\\ \Rightarrow?:))\\ 3.n_{KOH}=0,2.1=0,2mol\\ n_{H_2SO_4}=0,2.1=0,2mol\\ 2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\\ \Rightarrow\dfrac{0,2}{2}< \dfrac{0,2}{1}\Rightarrow H_2SO_4.dư\\ n_{H_2SO_4.pư}=\dfrac{1}{2}n_{KOH}=\dfrac{1}{2}\cdot0,2=0,1mol\\ n_{H_2SO_4_4.dư}=0,2-0,1mol\\ H_2SO_4+Mg\rightarrow MgSO_4+H_2\\ n_{H_2}=n_{H_2SO_4.dư}=0,1mol\\ V_{H_2}=0,1.24,79=2,479l\\ \Rightarrow A\)
Đúng 1
Bình luận (0)
a) Lấy chính xác 100ml dd H2SO4 0,2M và cho nước cất đến vạch 250ml. Tính nồng độ đương lượng của dung dịch mới và số gam H2SO4 có trong 10 ml dung dịch này. b) Tính nồng độ dung dịch HNO3 thu được khi trộn: • 500 g HNO3 10 % với 300 g HNO3 20% • 600 ml HNO3 2 N với 200 ml HNO3 4 N
Hấp thụ hoàn toàn V lít CO2 vào 250ml dung dịch hỗn hợp NaOH 0,4M và KOH aM thì thu được dung dịch X. Cho từ từ 250 ml dung dịch H2SO4 0,5M vào X thu được dung dịch Y và 1,68 lít khí. Cho Y tác dụng với Ba(OH)2 dư thấy xuất hiện 34,05 gam kết tủa trắng. Biết các khí đo ở đktc, giá trị của a là(không giải bằng ion ạ)