Đốt cháy hoàn toàn 11,2 lít khí C2H4 và C2H2 bằng 31,36 lít khí O2( biết các khí đều đo ở điều kiện tiêu chuẩn). Tính thể tích của mỗi khí trong hỗn hợp ban đầu.
Mọi người giúp em mai em thi rồi.
Đốt cháy hoàn toàn 13,44 lít hỗn hợp khí CH4 và C2H4, biết tỉ lệ thể tích giữa CH4 và C2H4 là 1:2. a, viết PTHH của phản ứng b, Tính thể tích khí CO2 sinh ra( biết thể tích các khí đc đo ở điều kiện tiêu chuẩn) giúp mình luôn với ạ
a) CH4 + 2O2 \(\underrightarrow{t^o}\) CO2 + 2H2O.
C2H4 + 3O2 \(\underrightarrow{t^o}\) 2CO2 + 2H2O.
b) Gọi x là lượng CH4 ban đầu, lượng C2H4 ban đầu là 2x.
Ta có: x+2x=13,44/22,4 \(\Rightarrow\) x=0,2.
Thể tích khí CO2 sinh ra là \(V_{CO_2}\)=(0,2+0,2.2.2).22,4=22,4 (lít).
Đốt cháy hoàn toàn 3,36,lít hỗ hợp khí A gồm metan và etan thu được 4,48 lít khí cacbonic. Các thể khí được đo ở điều kiện tiêu chuẩn. Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp A.
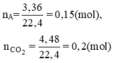
Gọi số mol của metan và etan lần lượt là x và y (mol)
Phương trình phản ứng:
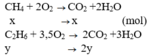
Vậy thành phần phần trăm về thể tích các khí trong hỗn hợp A là:
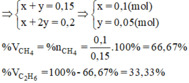
Đốt cháy hoàn toàn 10 lít hỗn hợp CH4 và C2H6 cần 30,5 lít khí Oxi . Tính % thể tích mỗi khí trong hỗn hợp ban đầu. Biết các thể tích khi đo ở cùng nhiệt độ và áp suất
Ko phải là điều kiện tiêu chuẩn nên các bạn đừng lấy 22,4 nha
đốt cháy hoàn toàn 22,4 lít C2H2 và C2H4 cần vừa đủ 60,48 lít o2 các khí đó ở điều kiện tiêu chuẩn A) tính VC2H4 và VC2H2 trong B) tính % Vc2h4 và % Vc2h2 C) tính khí CO2 sinh ra
\(n_{hh}=1mol\\ n_{O_2}=2,7mol\\ C_2H_2+\dfrac{5}{2}O_2\underrightarrow{t^{^0}}2CO_2+H_2O\\ C_2H_4+3O_2\underrightarrow{t^{^0}}2CO_2+2H_2O\\ n_{C_2H_2}=a;n_{C_2H_4}=b\\ n_{hh}=a+b=1\left(1\right)\\ n_{O_2}=\dfrac{5}{2}a+3b=2,7\left(2\right)\\ \left(1\right)\left(2\right)\Rightarrow a=0,6;b=0,4\\ \Rightarrow V_{C_2H_4}=0,6.22,4=13,44L\\ V_{C_2H_2}=22,4-13,44=8,96L\\ \%V_{C_2H_4}=\dfrac{0,4}{1}.100\%=40\%\\ \%V_{C_2H_2}=60\%\\ n_{CO_2}=2\left(a+b\right)=2mol\\ V_{CO_2}=2.22,4=44,8L\)
Đốt cháy hoàn toàn 11,2 lít khí metan. Hãy tính thể tích khí oxi cần dùng và thể tích khí cacbonic tạo thành. Biết các thể tích khí đo ở điều kiện tiêu chuẩn.
a) Những khí tác dụng với nhaư từng đôi một là:
CH4 và O2; CH4 và Cl2; H2 và O2; H2 và Cl2.
b) Những hỗn hợp nổ là những hỗn hợp khi phản ứng tỏa nhiều nhiệt, đó là các hỗn hợp: CH4 và O2; H2 và O2
Phương trình phản ứng
CH4 + 2O2 -> CO2 + 2H2O
nCH4 =11,2/22,4=0,5 mol
theo phương trình phản ứng : nCH4=2nO2 =>nO2=0,5.2=1 mol
VO2=n.22,4=1.22,4=22,4 l
nCO2=0,5 mol
=>VCO2=n.22,4=0,5.22,4=11,2 l
Đốt cháy hoàn toàn 4,48 lít hỗn hợp 2 khí metan và etilen cần dùng 11,2 lít khí oxi.Phần trăm theo thể tích các khí trong hỗn hợp ban đầu lần lượt là(các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất)
Đốt cháy 4,48 lít benzen hỗn hợp khí gồm etan etilen, cần dùng 14,56 lít o2. Các khí đo ở điều kiện tiêu chuẩn a. viết phương trình xảy ra b. tính phần trăm thể tích mỗi khí trong hỗn hợp trên
Để đốt cháy 5,6 lít khí etilen cần phải dùng:
a) Bao nhiêu lít oxi?
b) Bao nhiêu lít không khí chứa 1/5 thể tích oxi? Biết thể tích các khí đo ở điều kiện tiêu chuẩn.
Hỗn hợp A gồm CH4 và C2H4. Đốt cháy hoàn toàn 3,36 lít hỗn hợp A (đktc) thì thu được 8,8g khí cacbonic. Hãy tính thành phần % thể tích của mỗi khí trong hỗn hợp.
Câu 1:
\(a,PTHH:C_2H_4+5O_2\underrightarrow{t^o}2CO_2+2H_2O\)
\(n_{C_2H_4}=\dfrac{V_{\left(đktc\right)}}{22,4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(Theo.PTHH:n_{O_2}=5.n_{C_2H_4}=5.0,25=1,25\left(mol\right)\\ V_{O_2\left(đktc\right)}=n.22,4=1,25.22,4=28\left(l\right)\)
\(b,\Rightarrow V_{kk\left(đktc\right)}=5.V_{O_2\left(đktc\right)}=5.28=140\left(l\right)\)
B1:
\(C_2H_4+3O_2\rightarrow\left(t^o\right)2CO_2+2H_2O\)
Vì số mol tỉ lệ thuận với thể tích, đồng thời nhìn PTHH, ta sẽ được:
\(a,V_{O_2\left(đktc\right)}=3.V_{C_2H_4\left(đktc\right)}=3.5,6=16,8\left(l\right)\)
\(b,V_{kk}=5.V_{O_2\left(đktc\right)}=16,8.5=84\left(l\right)\)
B2:
Đặt số mol metan, etylen lần lượt là a,b (mol) (a,b>0)
\(n_{hh}=n_{CH_4}+n_{C_2H_4}=a+b=\dfrac{3,36}{22,4}=0,15\left(1\right)\)
PTHH: CH4 +2 O2 -to-> CO2 +2 H2O
C2H4 +3 O2 -to-> 2CO2 + 2H2O
\(n_{CO_2\left(tổng\right)}=a+2b=\dfrac{8,8}{44}=0,2\left(mol\right)\left(2\right)\)
(1), (2) =>a=0,1; b=0,05
Số mol tỉ lệ tương ứng với thể tích. Nên:
\(\%V_{CH_4}=\%n_{CH_4}=\dfrac{0,1}{0,15}.100\approx66,667\%\\ \Rightarrow\%V_{C_2H_4}\approx33,333\%\)
Câu3: Hỗn hợp khí B gồm CO,CO2 & khí H2 .Nếu đốt cháy hoàn toàn 4,48 lít khí B cần dùng 14,56 lít khí khí oxi;biết rằng 4,48 lít khí B đó có khối lượng bằng 46,4 g
Hãy tính % theo thể tích mỗi khí trong B(cho biết các thể tích khí đo ở điều kiện tiêu chuẩn )