Hợp chất A có công thức là XY2 ; trong đó tổng số hạt proton, notron, electron là 66; .Hạt mang điện của X,Y hơn kém nhau 20 hạt. Trong hạt nhân của nguyên tử X và Y đều có số hạt mang điện bằng số hạt không mang điện. Tìm công thức hóa học của A.

Những câu hỏi liên quan
Câu 4. Công thức hóa học hợp chất của nguyên tố X với nhóm SO4 có hóa trị II là X2(SO4)3. Công thức hóa học hợp chất của nguyên tố Y với hiđro là H3Y.Công thức hóa học hợp chất của nguyên tố X và nguyên tố Y là:A . XY2 B. XY3 C. XY D. X2Y3Câu 5. Đốt cháy hoàn toàn 12,8g đồng (Cu) trong bình chứa oxi (O2) thu được 16 gam đồng (II) oxit (CuO). Khối lượng oxi đã tham gia phản ứng làA. 6,40 gam B. 4,80 gam.C. 3,20 gam ...
Đọc tiếp
Câu 4. Công thức hóa học hợp chất của nguyên tố X với nhóm SO4 có hóa trị II là X2(SO4)3. Công thức hóa học hợp chất của nguyên tố Y với hiđro là H3Y.
Công thức hóa học hợp chất của nguyên tố X và nguyên tố Y là:
A . XY2 B. XY3 C. XY D. X2Y3
Câu 5. Đốt cháy hoàn toàn 12,8g đồng (Cu) trong bình chứa oxi (O2) thu được 16 gam đồng (II) oxit (CuO). Khối lượng oxi đã tham gia phản ứng là
A. 6,40 gam B. 4,80 gam.
C. 3,20 gam D. 1,67 gam.
(cho Cu = 64 , O = 16).
Câu 6. Khối lượng của 0,5mol Mg và 0,3mol CO2 tương ứng là
A. 10 gam Mg; 12 gam CO2
B. 13 gam Mg; 15 gam CO2
C. 12 gam Mg; 13,2 gam CO2
D. 14 gam Mg; 14,5 gam CO2
(cho Mg = 24 , O = 16 , C = 12).
Câu 4. Công thức hóa học hợp chất của nguyên tố X với nhóm SO4 có hóa trị II là X2(SO4)3. Công thức hóa học hợp chất của nguyên tố Y với hiđro là H3Y.
Công thức hóa học hợp chất của nguyên tố X và nguyên tố Y là:
A . XY2 B. XY3 C. XY D. X2Y3
Câu 5. Đốt cháy hoàn toàn 12,8g đồng (Cu) trong bình chứa oxi (O2) thu được 16 gam đồng (II) oxit (CuO). Khối lượng oxi đã tham gia phản ứng là
A. 6,40 gam B. 4,80 gam.
C. 3,20 gam D. 1,67 gam.
(cho Cu = 64 , O = 16).
Câu 6. Khối lượng của 0,5mol Mg và 0,3mol CO2 tương ứng là
A. 10 gam Mg; 12 gam CO2
B. 13 gam Mg; 15 gam CO2
C. 12 gam Mg; 13,2 gam CO2
D. 14 gam Mg; 14,5 gam CO2
(cho Mg = 24 , O = 16 , C = 12).
Đúng 1
Bình luận (0)
Cho biết CTHH hợp chất của nguyên tố X với oxi và hợp chất của nguyên tố Y với H là X2O và YH2.Hãy chọn công thức đúng cho hợp chất của X và Y trong số các công thức sau: XY2, X2Y, XY, X2Y3.
Xác định X, Y biết rằng:
- Hợp chất X2O có PTK là 62
- Hợp chất YH2 có PTK là 34.
Xác định X, Y biết rằng:
- Hợp chất X2O có PTK là 62
=> X hóa trị I
- Hợp chất YH2 có PTK là 34.
=> Y hóa trị II
=> Công thức đúng cho hợp chất của X và Y là X2Y
Đúng 3
Bình luận (0)
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32. Cấu hình electron phù hợp với X và Y là: A. X : 1s22s22p63s23p4, Y: 1s22s22p4 B. X : 1s22s22p63s2, Y: 1s22s22p4 C. X : 1s22s22p63s23p4, Y: 1s22s22p2 D. X : 1s22s22p63s23p2, Y: 1s22s22p6
Đọc tiếp
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32. Cấu hình electron phù hợp với X và Y là:
A. X : 1s22s22p63s23p4, Y: 1s22s22p4
B. X : 1s22s22p63s2, Y: 1s22s22p4
C. X : 1s22s22p63s23p4, Y: 1s22s22p2
D. X : 1s22s22p63s23p2, Y: 1s22s22p6
Đáp án A.
Gọi số hạt proton, nơtron, electron của nguyên tử X là p, n, e và của Y là p’, n’, e’.
Theo bài : p = n = e và p’ = n’ = e’.
Trong hợp chất XY2, X chiếm 50% về khối lượng nên:
![]()
Tổng số proton trong phân tử XY2 là 32 nên p + 2p’ = 32.
Từ đây tìm được: p = 16 (S) và p’ = 8 (O). Hợp chất cần tìm là SO2.
Cấu hình electron của S: 1s22s22p63s23p4 và của O: 1s22s22p4.
Đúng 0
Bình luận (0)
Một hợp chất có công thức
X
Y
2
trong đó Y chiếm 50% về khối lượng. Trong hạt nhân của X có n p và hạt nhân Y có n’ p’. Tổng số proton trong phân tử
X
Y
2
là 32. Cấu hình electron của X và Y và liên kết trong phân tử
X
Y
2
là A.
3
s
2
3
p...
Đọc tiếp
Một hợp chất có công thức X Y 2 trong đó Y chiếm 50% về khối lượng. Trong hạt nhân của X có n = p và hạt nhân Y có n’ = p’. Tổng số proton trong phân tử X Y 2 là 32. Cấu hình electron của X và Y và liên kết trong phân tử X Y 2 là
A. 3 s 2 3 p 4 , 2 s 2 2 p 4 và liên kết cộng hóa trị
B. 3 s 2 , 2 s 2 2 p 5 và liên kết ion
C. 3 s 2 3 p 5 , 4 s 2 và liên kết ion
D. 3 s 2 3 p 3 , 2 s 2 2 p 3 và liên kết cộng hóa trị
Chọn A
Y chiếm 50% về khối lượng → MX = 2MY → nX + pX = 2 nY + 2 pY (1)
nX = pX; nY = pY (2)
pX + 2pY = 32 (3)
→ pX = 16 (S): [Ne]3s23p4; pY = 8 (O): [He]2s22p4
Liên kết trong phân tử SO2 là liên kết cộng hóa trị.
Đúng 1
Bình luận (0)
Cho hợp chất của X là XO và Y là Na2Y. Công thức hợp chất tạo bởi X và Y là
A. XY.
B. X2Y.
C. X3Y.
D. XY2.
Cho biết công thức hóa học hợp chất của nguyên tố X với nhóm (
S
O
4
) và hợp chất của nhóm nguyên tử Y với H như sau:
X
2
S
O
4
3
;
H
3
Y
Hãy chọn công thức hóa học nào là đúng cho hợp chất của X và Y trong số các công thức cho...
Đọc tiếp
Cho biết công thức hóa học hợp chất của nguyên tố X với nhóm ( S O 4 ) và hợp chất của nhóm nguyên tử Y với H như sau: X 2 S O 4 3 ; H 3 Y
Hãy chọn công thức hóa học nào là đúng cho hợp chất của X và Y trong số các công thức cho sau đây:
| X Y 2 | Y 2 X | XY | X 2 Y 2 | X 3 Y 2 |
| (a) | (b) | (c) | (d) | (e) |
Trong CT: X 2 S O 4 3 nhóm ( S O 4 ) có hóa trị II, gọi hóa trị của X là x
Theo quy tắc hóa trị: x.2 = II.3 ⇒ x = III ⇒ X có hóa trị III.
Và trong H 3 Y biết H có hóa trị I, gọi hóa trị của Y là y
Theo quy tắc hóa trị: I.3 = y.1 ⇒ y = III ⇒ Y có hóa trị III.
CT hợp chất của X và Y là: X a Y b
Theo quy tắc hóa trị : III.a = III.y ⇒ 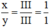
Vậy CT hợp chất X là XY.
⇒ Chọn C
Đúng 0
Bình luận (0)
Câu 8: Công thức hóa học của hợp chất tạo bởi nguyên tố X với nguyên tố Oxi là XO, của nguyên tố Y với nguyên tố hiđro là H3Y.Vậy công thức hóa học của hợp chất tạo bởi nguyên tố X với nguyên tố Y là : A. XY2 B. X3Y2 C. XY D. X2Y3
Đọc tiếp
Câu 8: Công thức hóa học của hợp chất tạo bởi nguyên tố X với nguyên tố Oxi là XO, của nguyên tố Y với nguyên tố hiđro là H3Y.Vậy công thức hóa học của hợp chất tạo bởi nguyên tố X với nguyên tố Y là :
A. XY2 B. X3Y2 C. XY D. X2Y3
Xem thêm câu trả lời
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32. Viết cấu hình electron của X. A. 1s22s22p63s23p4 B. 1s22s22p4 C. 1s22s22p63s2 D.1s22s22p63s23p2
Đọc tiếp
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32. Viết cấu hình electron của X.
A. 1s22s22p63s23p4
B. 1s22s22p4
C. 1s22s22p63s2
D.1s22s22p63s23p2
Đáp án A.
Gọi số hạt proton, nơtron, electron của nguyên tử X là p, n, e và của Y là p’, n’, e’.
Theo bài : p = n = e và p’ = n’ = e’.
Trong hợp chất XY2, X chiếm 50% về khối lượng nên:
M X 2 M Y = 50 50 ⇒ p + n 2 ( p ' + n ' ) = 1 ⇒ p = 2 p '
Tổng số proton trong phân tử XY2 là 32 nên p + 2p’ = 32.
Từ đây tìm được: p = 16 (S) và p’ = 8 (O). Hợp chất cần tìm là SO2.
Cấu hình electron của S: 1s22s22p63s23p4
Đúng 0
Bình luận (0)
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32.Cấu hình electron của X và Y A. X: 1s22s22p63s23p4 và Y: 1s22s22p4 B. X: 1s22s22p63s23p3 và Y: 1s22s22p4 C. X: 1s22s22p63s23p6 và Y: 1s22s22p4 D. X: 1s22s22p63s23p4 và Y: 1s22s22p6
Đọc tiếp
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32.Cấu hình electron của X và Y
A. X: 1s22s22p63s23p4 và Y: 1s22s22p4
B. X: 1s22s22p63s23p3 và Y: 1s22s22p4
C. X: 1s22s22p63s23p6 và Y: 1s22s22p4
D. X: 1s22s22p63s23p4 và Y: 1s22s22p6
Đáp án A
Gọi số hạt prroton, nơtron, electron của nguyên tử X là P, N, E và của Y là P’, N’, E’
Theo bài: P = N = E và P’ = N’ = E’
Trong hợp chất XY2, X chiếm 50% về khối lượng nên: ![]() = 1 « P = 2P’
= 1 « P = 2P’
Tổng số proton trong phân tử XY2 là 32 nên P + 2P’ = 32
Từ đây tìm được: P = 16 (S) và P’ = 8 (O)
Hợp chất cần tìm là SO2
Cấu hình electron của S: 1s22s22p63s23p4 và của O: 1s22s22p4
Đúng 0
Bình luận (0)



















