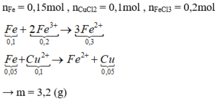Cho 10,5 gam hỗn hợp Mg, Al (tie lệ mol là 1:3) vào 250ml dung dịch CuCl2 1M. Khuấy kĩ cho phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Tính giá trị m?

Những câu hỏi liên quan
Cho 5,5 gam hỗn hợp bột Al và Fe (trong đó số mol của Al gấp đôi số mol của Fe) vào 300 ml dung dịch AgNO3 1M. Khuấy kĩ cho phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là. A. 33,95 B. 39,35 C. 35,39 D. 35,2
Đọc tiếp
Cho 5,5 gam hỗn hợp bột Al và Fe (trong đó số mol của Al gấp đôi số mol của Fe) vào 300 ml dung dịch AgNO3 1M. Khuấy kĩ cho phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là.
A. 33,95
B. 39,35
C. 35,39
D. 35,2
Đáp án : D
mAl + mFe = 5,5 và nAl =2nFe
=>nAl = 0,1 ; nFe = 0,05 mol
,nAgNO3 = 0,3 mol
Al + 3AgNO3 -> Al(NO3)3 + 3Ag
=> chất rắn gồm 0,3 molAg và 0,05 mol Fe
=> m = 35,2g
Đúng 0
Bình luận (0)
Cho 5,5 gam hỗn hợp bột AI và Fe (trong đó số mol AI gấp đôi số mol Fe) vào 300 ml dung dịch AgNO3 1M. Khuấy kĩ cho phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
A. 33,95 gam. B. 35,20 gam. C. 39,35 gam. D. 35,39 gam.
Gọi nFe = x (mol) ⇒ nAl = 2nFe = 2x (mol)
mhỗn hợp= 56x + 2x. 27 = 5,5⇒ x = 0,05 (mol)⇒ nFe = 0,05 (mol), nAl = 0,1 (mol)
nAgNO3 = 0,3.1 = 0,3 (mol)
Viết PTHH có xảy ra theo thứ tự:
Al + 3AgNO3 → Al(NO3)3 + 3Ag↓ (1)
Fe + 3AgNO3 → Fe(NO3)2+ 3Ag↓ (2)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag↓ (3)
nAl = 0,1 (mol); nAgNO3 = 0,3 (mol) ⇒ chỉ xảy ra phản ứng (1). Không xảy ra phản ứng (2) và (3)
⇒m rắn = mAg↓ + mFe dư = 3*0,1*108 + 0,05*56 = 35,2 (g)
Đúng 0
Bình luận (0)
Cho hỗn hợp X gồm hai kim loại Al, Fe (trộn đều theo tỉ lệ mol 2:1). Nếu cho 7,15 gam X vào 100 ml dung dịch AgNO3 3,9M rồi khuấy kỹ đến khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị m là A. 42,12 gam B. 32,4 gam C. 45,76 gam D. 47,56 gam
Đọc tiếp
Cho hỗn hợp X gồm hai kim loại Al, Fe (trộn đều theo tỉ lệ mol 2:1). Nếu cho 7,15 gam X vào 100 ml dung dịch AgNO3 3,9M rồi khuấy kỹ đến khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị m là
A. 42,12 gam
B. 32,4 gam
C. 45,76 gam
D. 47,56 gam
Do nAl : nFe = 2 : 1 và 27nAl + 56nFe = 7,15g
=> nAl = 0,13 mol ; nFe = 0,065 mol
nAgNO3 = 0,39 mol. Phản ứng xảy ra :
+/ Al + 3Ag+ → Al3+ + 3Ag
=>sau phản ứng có 0,39 mol Ag và 0,065 mol Fe
=> m = 45,76g
=>C
Đúng 0
Bình luận (0)
Cho 5,5 gam hỗn hợp bột Al và Fe ( tỉ lệ mol 2:1) vào 330 ml dung dịch AgNO31M. Khuấy kĩ cho oharn ứng xẩy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
A. 33,95 gam
B. 35,20 gam
C. 39,35 gam
D. 35,39 gam
Chọn B
Gọi số mol Fe là x => số mol Al là 2x
Ta có: 56x + 27.2x = 5,5 => x = 0,05; = 0,3.1 = 0,3 (mol)
Al + 3Ag+ → Al3+ + 3Ag
0,1 0,3 0,3 (mol)
Vậy chất rắn thu được gồm Fe và Ag; m = 0,05.56 + 108.0,3 = 35,2 (gam).
Đúng 0
Bình luận (0)
Cho 5,5 gam hỗn hợp bột Al và Fe ( tỉ lệ mol 2:1) vào 330 ml dung dịch AgNO31M. Khuấy kĩ cho oharn ứng xẩy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
A. 33,95 gam
B. 35,20 gam
C. 39,35 gam
D. 35,39 gam
Đúng 0
Bình luận (0)
Câu 5 (4,0 điểm): Cho 11 gam hỗn hợp kim loại Fe và Al theo tỉ lệ số mol 1 : 2 vào 700ml dung dịch AgNO3 1M. Khuấy đều cho phản ứng xảy ra hoàn toàn. a. Tính khối lượng chất rắn sau phản ứng? b. Tính nồng độ mol của dung dịch thu được. Giả sử thể tích dung dịch sau phản ứng không thay đổi.
Đọc tiếp
Câu 5 (4,0 điểm): Cho 11 gam hỗn hợp kim loại Fe và Al theo tỉ lệ số mol 1 : 2 vào 700ml
dung dịch AgNO3 1M. Khuấy đều cho phản ứng xảy ra hoàn toàn.
a. Tính khối lượng chất rắn sau phản ứng?
b. Tính nồng độ mol của dung dịch thu được. Giả sử thể tích dung dịch sau phản ứng
không thay đổi.
a) Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Al}=2a\left(mol\right)\end{matrix}\right.\left(a>0\right)\Rightarrow56a+27.2a=11\Leftrightarrow a=0,1\left(mol\right)\left(TM\right)\)
PTHH:
Al + 3AgNO3 ---> Al(NO3)3 + 3Ag
0,2->0,6--------->0,2---------->0,6
Fe + 2AgNO3 ---> Fe(NO3)2 + 2Ag
0,05<-0,1--------->0,05-------->0,1
=> \(m_{c.r\text{ắn}}=m_{Ag}+m_{Fe\left(d\text{ư}\right)}=0,7.108+0,05.56=78,4\left(g\right)\)
b) \(\left\{{}\begin{matrix}C_{M\left(Al\left(NO_3\right)_3\right)}=\dfrac{0,2}{0,7}=\dfrac{2}{7}M\\C_{M\left(Fe\left(NO_3\right)_2\right)}=\dfrac{0,05}{0,7}=\dfrac{1}{14}M\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Hỗn hợp A gồm: 0,36 gam Mg; 2,8 gam Fe. Cho A vào 250 ml dung dịch CuCl2, khuấy đều cho phản ứng xảy ra hoàn toàn, thu được dung dịch B và 3,84 gam chất rắn C. Nồng độ của dung dịch CuCl2 là A. 0,15M B. 0,5M C. 0,1M D. 0,05M
Đọc tiếp
Hỗn hợp A gồm: 0,36 gam Mg; 2,8 gam Fe. Cho A vào 250 ml dung dịch CuCl2, khuấy đều cho phản ứng xảy ra hoàn toàn, thu được dung dịch B và 3,84 gam chất rắn C. Nồng độ của dung dịch CuCl2 là
A. 0,15M
B. 0,5M
C. 0,1M
D. 0,05M
Cho 2,49 gam hỗn hợp Al và Fe (có tỉ lệ mol tương ứng 1:1) vào dung dịch chứa 0,17 mol HCl, thu được dung dịch X. Cho 200 ml dung dịch AgNO3 1M vào X, thu được khí NO và m gam chất rắn. Biết các phản ứng xảy ra hoàn toàn, NO là sản phẩm khử duy nhất của N+5. Giá trị của m gần nhất với giá trị nào sau đây? A. 25,0. B. 24,5. C. 27,5. D. 26,0.
Đọc tiếp
Cho 2,49 gam hỗn hợp Al và Fe (có tỉ lệ mol tương ứng 1:1) vào dung dịch chứa 0,17 mol HCl, thu được dung dịch X. Cho 200 ml dung dịch AgNO3 1M vào X, thu được khí NO và m gam chất rắn. Biết các phản ứng xảy ra hoàn toàn, NO là sản phẩm khử duy nhất của N+5. Giá trị của m gần nhất với giá trị nào sau đây?
A. 25,0.
B. 24,5.
C. 27,5.
D. 26,0.
Cho 5,1 gam hỗn hợp bột gồm Mg và Al có tỉ lệ mol 1:1 vào 150 ml dung dịch hỗn hợp chứa AgNO3 1M, Fe(NO3)3 0,8M, Cu(NO3)2 0,6M sau khi các phản ứng xảy ra hoàn toàn thấy có m gam rắn xuất hiện. Giá trị của m là A. 22,68 B. 24,32 C. 23,36 D. 25,26
Đọc tiếp
Cho 5,1 gam hỗn hợp bột gồm Mg và Al có tỉ lệ mol 1:1 vào 150 ml dung dịch hỗn hợp chứa AgNO3 1M, Fe(NO3)3 0,8M, Cu(NO3)2 0,6M sau khi các phản ứng xảy ra hoàn toàn thấy có m gam rắn xuất hiện. Giá trị của m là
A. 22,68
B. 24,32
C. 23,36
D. 25,26
Để xử lý bài toán này ta có thể hiểu theo kiểu nông dân. Số mol anion sẽ được phân bổ cho các kim loại từ mạnh nhất tới yếu hơn. Hết anion thì bọn kim loại yếu sẽ bị đẩy ra ngoài.
Ta có
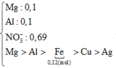
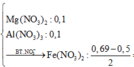
=0,095
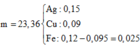
Đúng 0
Bình luận (0)
Cho 8,4 gam bột Fe vào 200 ml dung dịch chứa hỗn hợp gồm CuCl2 0,5M và FeCl3 1M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là:
A. 6,4.
B. 3,2.
C. 5,6.
D. 5,24.