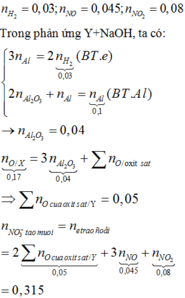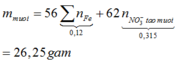Hòa tan hỗn hợp gồm 0,02 mol Cu, 0,03 mol Al và 0,01 mol Mg vào hỗn hợp dung dịch H2SO4 đặc, nóng + HNO3 đặc nóng dư thu đc 0,05 mol khí SO2 và a mol khí NO2 ( ko có khí nào khác ngoài 2 khí trên). Vậy a có trị là bao nhiêu ?

Những câu hỏi liên quan
Hòa tan hoàn toàn hỗn hợp gồm 0,05 mol Ag và 0,03 mol Cu vào dung dịch HNO3 dư thu được hỗn hợp khí X gồm NO và NO2 có tỉ lệ mol tương ứng là 2 : 3. Thể tích khí X (đktc) là:
A. 2,224
B. 2,737
C. 1,368
D. 3,374
Đáp án C.
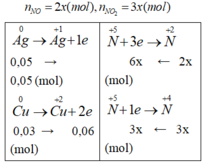
9x = 0,11; x= 11/900 => V = 5x.22,4 = 1,368 (l)
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn hỗn hợp X gồm Cu, Fe, Mg vào dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y chỉ chứa muối của kim loại và hỗn hợp khí gồm 0,01 mol N2, 0,02 mol NO. Số mol HNO3 đã phản ứng là A. 0,10 B. 0,12 C. 0,16 D. 0,20
Đọc tiếp
Hòa tan hoàn toàn hỗn hợp X gồm Cu, Fe, Mg vào dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y chỉ chứa muối của kim loại và hỗn hợp khí gồm 0,01 mol N2, 0,02 mol NO. Số mol HNO3 đã phản ứng là
A. 0,10
B. 0,12
C. 0,16
D. 0,20
Ở ví dụ 4, ta đã giải quyết câu hỏi này bằng bảo toàn nguyên tố, giờ với phương trình liên hệ mol H+ và sản phẩm khử, ta có ngay: nH+ = 12nN2 + 4nNO = 12.0,01 + 4.0,02 =0,2 mol
Chọn đáp án D
Đúng 0
Bình luận (0)
Trộn 0,1 mol Al với 0,03 mol Fe2O3 và 0,02 mol Fe3O4 thu được hỗn hợp X. Tiến hành phản ứng nhiệt nhôm hỗn hợp X trong bình kín không có không khí, sau một thời gian đem hòa tan hỗn hợp Y thu được bằng dung dịch NaOH dư thấy thoát ra 0,672 lít khí H2 (đktc) và còn hỗn hợp rắn khôngtan Z. Đem hòa tan hết Z bằng dung dịch HNO3 đặc, đun nóng thu được dung dịch T và 2,8 lít (đktc) hỗn hợp hai khí NO và NO2 có tỉ khối so với H2 là 20,12. Cô cạn T thấy không có khí mùi khai thoát ra và thu được m gam...
Đọc tiếp
Trộn 0,1 mol Al với 0,03 mol Fe2O3 và 0,02 mol Fe3O4 thu được hỗn hợp X. Tiến hành phản ứng nhiệt nhôm hỗn hợp X trong bình kín không có không khí, sau một thời gian đem hòa tan hỗn hợp Y thu được bằng dung dịch NaOH dư thấy thoát ra 0,672 lít khí H2 (đktc) và còn hỗn hợp rắn không
tan Z. Đem hòa tan hết Z bằng dung dịch HNO3 đặc, đun nóng thu được dung dịch T và 2,8 lít (đktc) hỗn hợp hai khí NO và NO2 có tỉ khối so với H2 là 20,12. Cô cạn T thấy không có khí mùi khai thoát ra và thu được m gam rắn khan. Giá trị của m là
A. 26,25
B. 29,04
C. 24,39
D. 27,80
Hòa tan hoàn toàn 19,36 gam hỗn hợp X gồm Fe, FeCO3, Fe2O3 bằng dung dịch HNO3 dư thu được dung dịch Z và 0,27 mol hỗn hợp khí gồm NO2, CO2. Nếu cho cùng lượng X tác dụng với dung dịch H2SO4 đặc, nóng dư thì thu được 0,165 mol hỗn hợp CO2, SO2. Phần trăm khối lượng của Fe2O3 trong X gần nhất với giá trị nào sau đây? A. 20%. B. 30%. C. 40%. D. 50%.
Đọc tiếp
Hòa tan hoàn toàn 19,36 gam hỗn hợp X gồm Fe, FeCO3, Fe2O3 bằng dung dịch HNO3 dư thu được dung dịch Z và 0,27 mol hỗn hợp khí gồm NO2, CO2. Nếu cho cùng lượng X tác dụng với dung dịch H2SO4 đặc, nóng dư thì thu được 0,165 mol hỗn hợp CO2, SO2. Phần trăm khối lượng của Fe2O3 trong X gần nhất với giá trị nào sau đây?
A. 20%.
B. 30%.
C. 40%.
D. 50%.
Nung hỗn hợp A gồm x mol Fe và 0,15 mol Cu trong không khí một thời gian thu được 63,2 gam hỗn hợp chất rắn B. Hòa tan hết hỗn hợp B bằng dung dịch H2SO4 đặc nóng, dư thu được 6,72 lít khí SO2 (đktc). Giá trị của X là: A. 0,4 mol. B. 0,5 mol. C. 0,6 mol. D. 0,7 mol.
Đọc tiếp
Nung hỗn hợp A gồm x mol Fe và 0,15 mol Cu trong không khí một thời gian thu được 63,2 gam hỗn hợp chất rắn B. Hòa tan hết hỗn hợp B bằng dung dịch H2SO4 đặc nóng, dư thu được 6,72 lít khí SO2 (đktc). Giá trị của X là:
A. 0,4 mol.
B. 0,5 mol.
C. 0,6 mol.
D. 0,7 mol.
Đáp án C
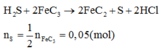
Chú ý: Không tồn tại muối sunfua của Al và Fe(III). H2S không phản ứng với AlCl3 nhưng nếu
![]()
Có sự khác nhau này do Fe3+ có tính oxi hóa mạnh còn Al3+ tính oxi hóa yếu
Đúng 0
Bình luận (0)
Nung hỗn hợp A gồm x mol Fe và 0,15 mol Cu trong không khí một thời gian thu được 63,2 gam hỗn hợp chất rắn B. Hòa tan hết hỗn hợp B bằng dung dịch H2SO4 đặc nóng, dư thu được 6,72 lít khí SO2 (đktc). Giá trị của X là: A. 0,4 mol. B. 0,5 mol. C. 0,6 mol. D. 0,7 mol.
Đọc tiếp
Nung hỗn hợp A gồm x mol Fe và 0,15 mol Cu trong không khí một thời gian thu được 63,2 gam hỗn hợp chất rắn B. Hòa tan hết hỗn hợp B bằng dung dịch H2SO4 đặc nóng, dư thu được 6,72 lít khí SO2 (đktc). Giá trị của X là:
A. 0,4 mol.
B. 0,5 mol.
C. 0,6 mol.
D. 0,7 mol.
Hoà tan 15 gam hỗn hợp X gồm 2 kim loại Al và Mg vào dung dịch Y gồm HNO3 và H2SO4 đặc thu được 0,1 mol mỗi khí SO2, NO, NO2, N2O (không còn sản phẩm khử khác). % khối lượng Al trong hỗn hợp X là (Al27, Mg24) A. 63% B. 46% C. 36% D. 50%
Đọc tiếp
Hoà tan 15 gam hỗn hợp X gồm 2 kim loại Al và Mg vào dung dịch Y gồm HNO3 và H2SO4 đặc thu được 0,1 mol mỗi khí SO2, NO, NO2, N2O (không còn sản phẩm khử khác). % khối lượng Al trong hỗn hợp X là (Al=27, Mg=24)
A. 63%
B. 46%
C. 36%
D. 50%
Đáp án : C
Bảo toàn e :
3nAl + 2nMg= 2 n S O 2 + 3 n N O + n N O 2 + 8 n N 2 O = 1,4 mol
Và 27nAl + 24nMg = 15g
=> nAl = 0,2 mol
=> %mAl = 36%
Đúng 0
Bình luận (0)
Câu 8: Hòa tan 15 gam hỗn hợp X gồm 2 kim loại Mg và Al vào dung dịch gồm HNo3 và H2SO4 đặc thu được 0,1 mol mỗi khí SO2, NO, NO2, N2O. Phần trăm khối lượng của Al và Mg trong X lần lượt là?
\(n_{Mg}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(24a+27b=15\left(1\right)\)
Bảo toàn e :
\(2a+3b=0.1\cdot\left(2+3+1+8\right)\left(2\right)\)
\(\left(1\right),\left(2\right):\)
\(a=0.4,b=0.2\)
\(\%Mg=64\%,\%Al=36\%\)
Đúng 2
Bình luận (0)
Gọi số mol Mg và Al lần lượt là a;b(mol)
$\Rightarrow 24a+27b=15$
Bảo toàn e ta có: $2a+3b=1,4$
Giải hệ ta được $a=0,4;b=0,2$
$\Rightarrow \%m_{Mg}=64\%;\%m_{Al}=36\%$
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn hỗn hợp X gồm Cu, Fe, Mg vào dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y chỉ chứa muối của kim loại và hỗn hợp khí gồm 0,01 1mol N2, 0,02 mol NO. Số mol HNO3 đã phản ứng là A. 0,10 B. 0,12 C. 0,16 D. 0,20
Đọc tiếp
Hòa tan hoàn toàn hỗn hợp X gồm Cu, Fe, Mg vào dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y chỉ chứa muối của kim loại và hỗn hợp khí gồm 0,01 1mol N2, 0,02 mol NO. Số mol HNO3 đã phản ứng là
A. 0,10
B. 0,12
C. 0,16
D. 0,20