Quá trình tạo thành ion Al3+, O2- nào sau đây là đúng?
A. Al → Al3+ + 2e, O → O2- + 2e. B. Al → Al3+ + 3e, O + 2e → O2-.
C. Al → Al3++ 3e, O → O2- + 1e. D. Al + 2e → Al3+, O + 1e → O2-.
Sơ đồ tạo thành ion nào sau đây là sai?
A. Li → Li+ + 1e.
B. Be → Be2+ + 2e.
C. O + 2e → O2-.
D. Ne + 2e → Ne2-.
Mọi người giải thích giúp mình câu này với ạ
Viết phương tình biểu diễn sự hình thành các ion sau đây từ các nguyên tử tương ứng:
Na → Na+ ; Cl → Cl-
Mg → Mg2+; S → S2-
Al → Al3+; O → O2-
Na → Na+ + 1e; Cl + 1e → Cl-
Mg → Mg2+ + 2e; S + 2e → S2-
Al → Al3+ + 3e; O +2e → O2-
Cho điện tích hạt nhân O (Z = 8), Na (Z = 11), Mg (Z = 12), Al (Z = 13) và các hạt vi mô: O 2 - , A l 3 + , A l , N a , M g 2 + , M g . Dãy nào sau đây được xếp đúng thứ tự bán kính hạt?
A. A l 3 + < M g 2 + < O 2 - < A l < M g < N a
B. A l 3 + < M g 2 + < A l < M g < N a < O 2 -
C. N a < M g < A l < A l 3 + < M g 2 + < O 2 -
D. N a < M g < M g 2 + < A l 3 + < A l < O 2 -
A
Ta thấy :
+) A l 3 + , M g 2 + , O 2 - đều có chung cấu hình là : 1 s 2 2 s 2 2 p 6
Các ion đẳng e (cùng e): so sánh điện tích trong nhân, điện tích hạt nhân càng lớn => lực hút electron càng lớn => bán kính càng nhỏ.
=> Theo chiều tăng dần bán kính : A l 3 + < M g 2 + < O 2 - .
+) Na, Mg và Al thuộc cùng chu kỳ 3, ZNa < ZMg < ZAl nên bán kính: Al < Mg < Na.
+) Xét số lớp electron: Số lớp electron càng lớn, bán kính hạt càng lớn.
→ Thứ tự sắp xếp đúng: A l 3 + < M g 2 + < O 2 - < A l < M g < N a .
Hỗn hợp X gồm N 2 v à H 2 có n H 2 = 0 , 4 m o l ; A l → A l 3 + + 3 e ; M g → M g 2 + + 2 e . Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết hiệu suất tổng hợp N H 3 đạt 40% thì thu được hỗn hợp Y. có giá trị là :
A. 15,12
B.18,23
C.14,76
D.13,48
Chọn C
Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có :
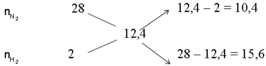
![]()
Với tỉ lệ trên suy ra H2 thiếu, hiệu suất phản ứng tính theo H2.
Trong hỗn hợp X ta chọn n N 2 = 2 n H 2 = 3
Số mol H2 phản ứng là 3.40% = 1,2 mol, suy ra số mol N2 phản ứng là 0,4 mol, số mol NH3 sinh ra là 0,8 mol. Sau phản ứng số mol khí giảm là (1,2 + 0,4) – 0,8 = 0,8 mol.
Sau phản ứng số mol khí giảm là 0,8 mol nên : n Y = n x − 0 , 8 = 2 + 3 − 0 , 8 = 4 , 2 mol
Theo định luật bảo toàn khối lượng ta có : m Y = m x = m N 2 + m H 2 = 2 . 28 + 3 . 2 = 62 gam
Vậy M ¯ Y = m Y n Y = 62 4 , 2 = 14 , 76
Câu 1. Khí oxi có công thức là
A. O. B. O2. C. O3. D. O4.
Câu 2. Kim loại nhôm có công thức là
A. Al. B. Al. C. Al2. D. Al3.
Câu 3. Công thức nào sau đây là của đơn chất?
A. H2O. B. NaCl. C. BaCl2. D. Cl2.
Câu 4. Công thức nào sau đây là của hợp chất?
A. H2. B. NaOH. C. O2. D. Cl2.
Câu 5. Hóa trị là con số biểu thị:
A. Khả năng phản ứng của các nguyên tử.
B. Khả năng liên kết của các nguyên tử hay nhóm nguyên tử.
C. Khả năng phân li các chất.
D. Tất cả đều đúng.
Câu 6. Hóa trị của 1 nguyên tố được xác định theo hóa trị của nguyên tố khác như thế nào?
A. H chọn làm 2 đơn vị B. O là 1 đơn vị.
C. H chọn làm 1 đơn vị, O là 2 đơn vị. D. H chọn làm 2 đơn vị, O là 1 đơn vị.
Câu 7. Công thức hóa học của hợp chất tạo bởi Na(I) với O(II) là
A. Na3O . B. NaO2. C. NaO D. Na2O.
Câu 8. Công thức hóa học của hợp chất tạo bởi Ca(II) với OH(I) là
A. CaOH. B. Ca(OH)2 C. Ca2OH. D. Ca3OH.
Câu 9. Công thức hoá học của hợp chất tạo bởi Cr(III) và O(II) là
A. CrO. B. Cr2O3. C. CrO2. D. CrO3.
Câu 10. Công thức hoá học của hợp chất tạo bởi Al(III) và Cl(I) là
A. AlCl3. B. AlCl2. C. AlCl4. D. Al3Cl.
Cho các hạt vi mô : O2-, Al3+, Al, Na, Mg2+, Mg. Dãy được xếp đúng thứ tự bán kính hạt ?
A. Al3+< Mg2+ < O2- < Al < Mg < Na.
B. Al3+< Mg2+< Al < Mg < Na < O2-.
C. Na < Mg < Al < Al3+ < Mg2+ < O2-.
D. Na < Mg < Mg2+< Al3+< Al < O2-.
Trong các nguyên tử và ion : Ne, Na, Mg, Al, Al3+, Mg2+, Na+ , O2–, F–, hạt có bán kính lớn nhất và hạt có bán kính nhỏ nhất là
A. Al3+, O2–
B. Na, Al3+
C. Na, Ne
D. O2–, Na+
Đáp án : B
Các nguyên tử ion có số lớp e nhiều hơn thì bán kính lớn hơn
Các nguyên tử ion có cùng số lớp e
cùng số e thì nguyên tử ion nào có điện tích âm sẽ có bán kính lớn hơn và ngược lại
Cho các hạt sau: Al, Al3+, Na, Na+, Mg, Mg2+, F-, O2−. Dãy các hạt xếp theo chiều giảm dần bán kính là
A. Na > Mg > Al > O 2−> F - > Na+ > Mg2+ > Al3+
B. Al > Mg > Na > O 2−> F - > Na+ > Mg2+ > Al3+
C. Na > Mg > Al > O 2−> F - > Al3+ > Mg2+ > Na+
D. Na > Mg > Al > F-> O2 − > Al3+ > Mg2+ > Na+
Đáp án A
+ Để so sánh bán kính các ion hay nguyên tử ta quan tâm tới số lớp trước theo nguyên tắc lớp càng nhiều thì bán kính càng lớn.(Na, Mg, Al có 3 lớp)
+ Nếu cùng lớp thì Z càng nhỏ thì bán kính càng lớn.
+ Vậy Na > Mg > Al > O 2−> F - > Na+ > Mg2+ > Al3+.
Những phát biểu nào sau đây là đúng?
Hợp chất tạo nên bởi ion Al3+ và O2- là hợp chất
(a) cộng hóa trị
(b) ion
(c) có công thức Al2O3
(d) có công thức Al3O2
- Hợp chất tạo nên bởi ion Al3+ (mang điện tích dương) và ion O2- (mang điện tích âm)
=> 2 ion trái dấu tạo nên hợp chất ion
- Gọi công thức hợp chất: \(Al_x^{3 + }O_y^{2 - }\): (+3).x + (-2).y = 0
=> x = 2, y = 3
=> Công thức: Al2O3
=> Phát biểu (b) và (c) đúng