Viết cấu hình e của các ion florua và ion canxi. Hãy biểu diễn sự tạo thành phân tử canxi
florua từ Ca và F2

Những câu hỏi liên quan
hợp chất ion A được tạo bởi các ion đều có cấu hình e 1s2 2s2 2p6. Tổng số hạt proton trong A là 30. Tìm công thức phân tử của A. Biểu diễn sự hình thành liên kết tạo nên phân tử A
a) Viết phương trình biểu diễn sự hình thành các ion sau đây từ các nguyên tử tương ứng:Na - Na+ ; Cl - Cl-Mg - Mg2+ ; S - S2-Al - Al3+ ; O - O2-b) Viết cấu hình electron của các nguyên tử và các ion. Nhận xét về cấu hình electron lớp ngoài cùng của các ion được tạo thành.
Đọc tiếp
a) Viết phương trình biểu diễn sự hình thành các ion sau đây từ các nguyên tử tương ứng:
Na -> Na+ ; Cl -> Cl-
Mg -> Mg2+ ; S -> S2-
Al -> Al3+ ; O -> O2-
b) Viết cấu hình electron của các nguyên tử và các ion. Nhận xét về cấu hình electron lớp ngoài cùng của các ion được tạo thành.
a) Na -> Na+ + 1e ; Cl + 1e -> Cl-
Mg -> Mg2+ + 2e ; S + 2e -> S2-
Al -> Al3+ + 3e ; O + 2e -> O2-
b) Cấu hình electron của các nguyên tử và các ion:
11Na: 1s22s22p63s1 ; Na+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
17Cl: 1s22s22p63s23p5 ; Cl - : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
12Mg: 1s22s22p63s2 ; Mg2+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
16S: 1s22s22p63s23p4 ; S2- : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
13Al: 1s22s22p63s23p51 ; Al3+ : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
8O: 1s22s22p4 ; O2- : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
Đúng 0
Bình luận (0)
Trình bày sự tạo thành liên kết ion của các chất sau: Na2S - Viết phương trình tạo thành phân tử các chất trên từ các đơn chất tương ứng có biểu diễn sự chuyển electron giữa các chất.
Na --> Na+ + 1e
S + 2e --> S2-
2 ion Na+ và S2- trái dấu nên hút nhau bởi lực hút tĩnh điện
2Na+ + S2- --> Na2S
Đúng 1
Bình luận (0)
a) Viết phương trình biểu diễn sự hình thành các ion sau đây từ các nguyên tử tương ứng:Na - Na+ ; Cl - Cl-Mg - Mg2+ ; S - S2-Al - Al3+ ; O - O2-b) Viết cấu hình electron của các nguyên tử và các ion. Nhận xét về cấu hình electron lớp ngoài cùng của các ion được tạo thành.
Đọc tiếp
a) Viết phương trình biểu diễn sự hình thành các ion sau đây từ các nguyên tử tương ứng:
Na -> Na+ ; Cl -> Cl-
Mg -> Mg2+ ; S -> S2-
Al -> Al3+ ; O -> O2-
b) Viết cấu hình electron của các nguyên tử và các ion. Nhận xét về cấu hình electron lớp ngoài cùng của các ion được tạo thành.
a) Na -> Na+ + 1e ; Cl + 1e -> Cl-
Mg -> Mg2+ + 2e ; S + 2e -> S2-
Al -> Al3+ + 3e ; O + 2e -> O2-
b) Cấu hình electron của các nguyên tử và các ion:
11Na: 1s22s22p63s1 ; Na+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
17Cl: 1s22s22p63s23p5 ; Cl - : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
12Mg: 1s22s22p63s2 ; Mg2+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
16S: 1s22s22p63s23p4 ; S2- : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
13Al: 1s22s22p63s23p51 ; Al3+ : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
8O: 1s22s22p4 ; O2- : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
Đúng 0
Bình luận (0)
Viết phương trình hóa học, biểu diễn sự cho - nhận electron tạo thành các hợp chất ion từ các đơn chất:
a) Natri (Z=11) và Clo (Z=17). b) Kali (Z=19) và Oxi (Z=8)
c) Canxi (Z=20) và Clo (Z=17) d) Magie (Z=12) và Oxi (Z=8)
a)
Na0 --> Na+ + 1e
Cl0 + 1e --> Cl-
Do ion Na+ và Cl- trái dấu nên chúng hút nhau bởi lực hút tĩnh điện:
Na+ + Cl- --> NaCl
b)
K0 --> K+ + 1e
O0 + 2e --> O-2
Do ion K+ và O-2 trái dấu nên chúng hút nhau bởi lực hút tĩnh điện:
2K+ + O-2 --> K2O
c)
Ca0 --> Ca+2 + 2e
Cl0 +1e--> Cl-
Do ion Ca+2 và Cl- trái dấu nên chúng hút nhau bởi lực hút tĩnh điện:
Ca+2 + 2Cl- --> CaCl2
d)
Mg0 --> Mg+2 + 2e
O0 + 2e --> O-2
Do ion Mg+2 và O-2 trái dấu nên chúng hút nhau bởi lực hút tĩnh điện:
Mg+2 + O-2 --> MgO
Đúng 1
Bình luận (0)
Hãy viết phương trình biểu diễn sự hình thành các ion và nhận xét về số electron lớp ngoài cùng, của các ion: Na+, Mg2+, Al3+, Cl-, S2-
\(Na\rightarrow Na^++e\)
\(Mg\rightarrow Mg^{2+}+2e\)
\(Al\rightarrow Al^{3+}+3e\)
\(Cl+e\rightarrow Cl^-\)
\(S+2e\rightarrow S^{2-}\)
Cấu hình:
\(Na^+:1s^22s^22p^6\) giống cấu hình của \(Ne\)
\(Mg^{2+}:1s^22s^22p^6\) giống cấu hình của \(Ne\)
\(Al^{3+}:1s^22s^22p^6\) giống cấu hình của \(Ne\)
\(Cl^-:1s^22s^22p^63s^23p^6\) giống cấu hình của \(Ar\)
\(S^{2-}:1s^22s^22p^63s^23p^6\) giống cấu hình của \(Ar\)
Đúng 2
Bình luận (0)
Viết cấu hình electron của các nguyên tử và các ion. Nhận xét về cấu hình electron lớp ngoài cùng của các ion được tạo thành.
Cấu hình electron của các nguyên tử và các ion:
11Na : 1s22s22p63s1; Na+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
17Cl : 1s22s22p63s23p5; Cl-: 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
12Mg: 1s22s22p63s2; Mg2+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
16S : 1s22s22p63s23p4; S2-: 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
13Al : 1s22s22p63s23p1; Al3+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
8O : 1s22s22p4; O2-: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
Đúng 0
Bình luận (0)
Quan sát Hình 6.2, em hãy mô tả sự tạo thành ion sodium, ion magnesium. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào?
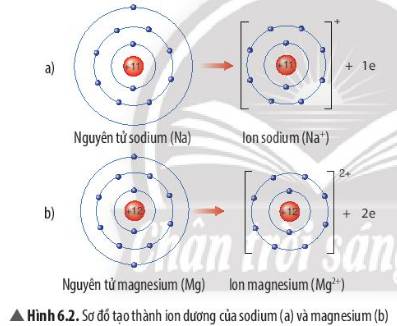
- Sự tạo thành ion sodium: Nguyên tử sodium (Na) cho đi 1 electron lớp ngoài cùng để tạo thành ion dương Na+
- Sự tạo thành ion magnesium: Nguyên tử magnesium (Mg) cho đi 2 electron lớp ngoài cùng để tạo thành ion dương Mg2+
=> Sau khi nhường electron, ion sodium và ion magnesium đều có 2 lớp electron và có 8 electron ở lớp ngoài cùng
=> Sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne)
Đúng 0
Bình luận (0)
Quan sát Hình 6.3, em hãy mô tả sự tạo thành ion chloride, ion oxide. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào?
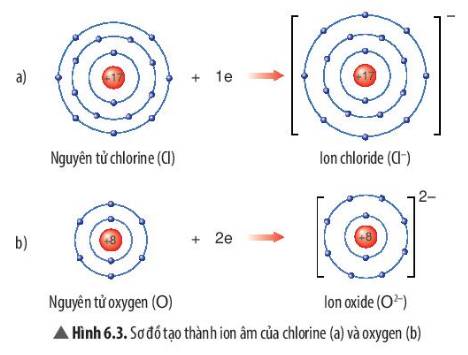
- Sự tạo thành ion chloride: Nguyên tử chlorine (Cl) nhận thêm 1 electron ở lớp ngoài cùng để tạo thành ion âm Cl-
- Sự tạo thành ion oxide: Nguyên tử oxygen (O) nhận thêm 2 electron ở lớp ngoài cùng để tạo thành ion âm O2-
- Sau khi nhận electron, ion chloride có 3 lớp electron và có 8 electron ở lớp ngoài cùng
=> Giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne)
- Sau khi nhận electron, ion oxide có 2 lớp electron và có 8 electron ở lớp ngoài cùng
=> Giống sự phân bố electron của nguyên tử Argon (Ar)
Đúng 0
Bình luận (0)

















