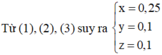Đốt cháy x(gam) cacbon trong bình kín chứa 32 gam O2.Khi phản ứng xong trong bình kín không còn chất rắn mà chỉ chứa hỗn hợp khí có tỉ khối hơi so với khí hidro là 19. [Các khí đo cùng điều kiện nhiệt độ và áp suất]
a.Hỗn hợp khí trong bình là khí gì?Tính thành phần phần trăm về thể tích mỗi khí trong hỗn hợp;
b.Tính khối lượng cacbon ban đầu(Tính x);

















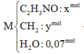
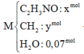
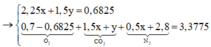
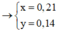
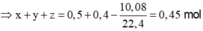 (1)
(1)