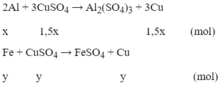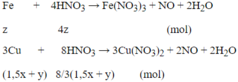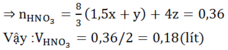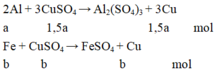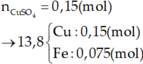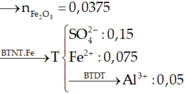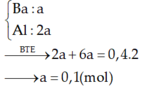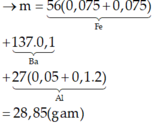Cho 4,15 gam hỗn hợp Fe và Al ở dạng bột, tác dụng với 200ml dung dịch CuSO4 0,525M. Khuấy kỹ hỗn hợp để các phản ứng xảy ra hoàn toàn. Lọc thu được kết tủa A gồm hai kim loại có khối lượng 7,84 gam và dung dịch nước lọc B.
a/ Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu, biết rằng khi phản ứng thì Al phản ứng trước, hết Al mới đến Fe.
b/ Tính thể tích dung dịch H2SO498% ( d = 1,84 g/ml)đun nóng để hòa tan hết kết tủa A nói trên, biết rằng phản ứng giải phóng khí SO2 là sản phẩm khử duy nhất.