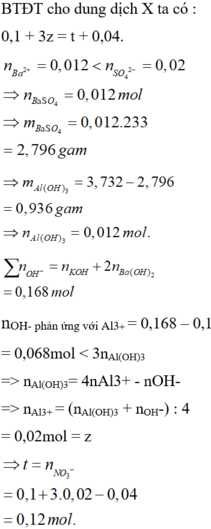Dung dịch X gồm 0,1 mol H+ ; a mol Al3+; b mol N O 3 - ; 0,02 mol S O 4 2 - . Cho 120 ml dung dịch Y gồm KOH 1,2M và Ba(OH)2 0,1M vào dung dịch X sau khi kết thúc phản ứng thu được 3,732 gam kết tủa. Giá trị của a, b lần lượt là:
A. 0,02 và 0,12
B. 0,120 và 0,020
C. 0,012 và 0,096
D. 0,02 và 0,012