Cho m gam kim loại M vào 200 ml dung dịch HCl 0,1M tới phản ứng hoàn toàn thu được 0,56 lít khí ở đktc và dung dịch X. Cho X tác dụng với dung dịch AgNO3 dư thu được m1 gam kết tủa. Giá trị của m1 là ?
A. 9,83
B. 2,87
C. 5,74
D. 6,35
Cho 31,6 gam hỗn hợp X gồm Fe, Fe3O4, Cu, CuO vào 500 ml dung dịch HCl 2M, thu được 4,48 lít khí H2 (đktc), dung dịch Y và 1,6 gam chất rắn. Lấy phần dung dịch Y cho tác dụng với lượng dư dung dịch AgNO3, thu được 0,56 lít khí NO (sản phẩm khử duy nhất của N+5, ở đktc) và m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 154,3
B. 173,2
C. 143,5
D. 165,1
Đáp án B
Dung dịch Y chứa Fe2+ (x mol), Cu2+ (y mol), H+ , Cl- (1 mol).
Khi cho Y tác dụng với dung dịch AgNO3 thì:
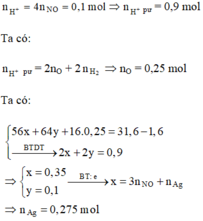
Kết tủa thu được gồm AgCl (1 mol) và Ag (0,275 mol)
=> m = 173,2 (g)
Cho 31,6 gam hỗn hợp X gồm Fe, Fe3O4, Cu, CuO vào 500 ml dung dịch HCl 2M, thu được 4,48 lít khí H2 (đktc), dung dịch Y và 1,6 gam chất rắn. Lấy phần dung dịch Y cho tác dụng với lượng dư dung dịch AgNO3, thu được 0,56 lít khí NO (sản phẩm khử duy nhất của N+5, ở đktc) và m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 154,3.
B. 173,2.
C. 143,5.
D. 165,1.
Cho m1 gam Al vào 100 ml dung dịch gồm Cu(NO3)2 0,3M và AgNO3 0,3M. Sau khi các phản ứng xảy ra hoàn toàn thì thu được m2 gam chất rắn X. Nếu cho m2 gam X tác dụng với lượng dư dung dịch HCl thì thu được 0,336 lít khí (ở đktc). Giá trị của m1 và m2 là
A. 8,10 và 5,43 gam
B. 1,08 và 5,43 gam
C. 0,54 và 5,16 gam
D. 1,08 và 5,16 gam
Cho m1 gam Al vào 100 ml dung dịch gồm CuSO4 0,3M và AgNO3 0,3M. Sau khi các phản ứng xảy ra hoàn toàn thì thu được m2 gam chất rắn X. Nếu cho m2 gam X tác dụng với lượng dư dung dịch HCl thì thu được 0,672 lít khí ( ở đktc). Giá trị của m1 và m2 lần lượt là
A. 1,08 và 5,43
B. 1,35 và 5,43
C. 1,35 và 5,70
D. 1,08 và 5,16
Đáp án C
Do X tác dụng với HCl sinh ra khí nên Al dư, CuSO4 và AgNO3 hết
nAl dư=nH2/1,5=0,02 mol
nCu=nCuSO4=0,03 mol
nAg=nAgNO3=0,03 mol
BT e: 3nAl pư=2nCu+nAg=> nAg pư=(0,03.2+0,03)/3=0,03 mol
m1=(0,03+0,02).27=1,35 gam
m2=0,03.64+0,03.108+0,02.27=5,7 gam
Cho a gam kim loại R tan hoàn toàn trong 200 ml dung dịch HCl 0,5M, thu được dung dịch X và 2,24 lít H2 (đktc). Cho dung dịch AgNO3 dư vào X, thu được m gam kết tủa. Giá trị của m là
A. 25,95.
B. 14,35.
C. 32,84.
D. 28,70.
Giải thích:
nHCl = 0,2.0,5 = 0,1 (mol); nH2 = 2,24 :22,4 = 0,1 (mol)
=> nHCl < 2nH2
=> R là kim loại kiềm hoặc kiềm thổ, phản ứng hết với HCl sau đó phản ứng được với H2O
2R + 2nHCl → RCln + nH2↑
0,1 → 0,05
2R + 2nH2O → 2R(OH)n + nH2↑
0,1/n ←0,05
RCln + nAgNO3 → nAgCl↓ + R(NO3)n
2R(OH)n + 2nAgNO3 → nAg2O↓ + R(NO3)n + nH2O
0,1/n → 0,05
=> m↓ = mAgCl + mAg2O = 0,1.143,5 + 0,05. 232 = 25,95(g)
Chú ý:
Tránh sai lầm khi chỉ tính khối lượng kết tủa là AgCl khi đó sẽ ra 14,35 g => chọn ngay đáp án B sẽ dẫn đến sai lầm
Đáp án A
Cho m1 gam Al vào 100 ml dung dịch gồm Cu(NO3)2 0,3M và AgNO3 0,3M. Sau khi các phản ứng xảy ra hoàn toàn thì thu được m2 gam chất rắn X. Nếu cho m2 gam X tác dụng với lượng dư dung dịch HCl thì thu được 0,336 lít khí (ở đktc). Giá trị của m1 và m2 lần lượt là
A. 1,08 và 5,43
B. 0,54 và 5,16.
C. 8,10 và 5,43.
D. 1,08 và 5,16.
Đáp án A
Do X tác dụng được với HCl ⇒ Al dư. Bảo toàn electron: nAl dư = 0,01 mol.
Bảo toàn gốc NO3: nNO3–/dung dịch sau = 0,09 mol. Bảo toàn điện tích: nAl3+ = 0,03 mol.
► Bảo toàn nguyên tố Al: m1 = 27 × (0,03 + 0,01) = 1,08(g). Lại có :
X gồm 0,03 mol Cu; 0,03 mol Ag và 0,01 mol Al dư ||⇒ m2 = 5,43(g)
⇒ chọn A
Cho m (gam) Fe vào V (ml) dung dịch AgNO3 1,0M đến khi phản ứng hoàn toàn thu được m1 (gam) hỗn hợp kim loại (X). Chia m1 (gam) X thành 2 phần. Phần 1 có khối lượng m2 (gam) cho tác dụng với lượng dung dịch HCl dư thu được 2,24 lít khí. Phần 2 có khối lượng m3(gam) cho tác dụng với lượng dư dung dịch H2SO4 đặc nóng thu được 8,96 lít khí SO2 (SO2 là sản phẩm khử duy nhất của H2SO4). Biết các phản ứng xảy ra hoàn toàn, khí đo ở điều kiện tiêu chuẩn và m3 - m2 = 16,4
a/ Viết các phương trình phản ứng xảy ra.
b/ Tìm m và V.
a)X gồm Fe,Ag
\(Fe + 2AgNO_3 \to Fe(NO_3)_2 + Ag(1)\\ Fe + 2HCl \to FeCl_2 + H_2(2)\\ 2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O(3)\\ 2Ag + 2H_2SO_4 \to Ag_2SO_4 + SO_2 + 2H_2O(4)\\\)
b) Phần 1,gọi n\(n_{Ag} = a(mol)\)
Theo PTHH (2) : \(n_{Fe} = n_{H_2} = 0,1(mol)\)
Suy ra : m2 = 0,1.56 + 108a = 5,6 + 108a(gam)
Phần 2, \(n_{Ag} = ak(mol) ; n_{Fe} = 0,1k(mol)\)
Theo PTHH (3)(4) : \(n_{SO_2} = \)0,5.ak + 0,1k.1,5 = 0,5ak + 0,15k = 0,4
⇒ k(0,5a + 0,15) = 0,4(1)
m3 = 108.ak + 0,1k.56 (gam)
Ta có :
\(m_3 - m_2 = 16,4 \Rightarrow m_3 = 16,4 + m_2\)
⇔ k(108a + 5,6) = 16,4 + 5,6 + 108a = 22+ 108a(2)
Ta lấy (1) : (2), ta có :
\(\dfrac{0,5a + 0,15}{108a + 5,6} = \dfrac{0,4}{22 + 108a}\)⇒ a = 0,1
Vậy : k = \(\dfrac{0,4}{0,5a + 0,15} = 2\)
Vậy X gồm :
Fe : 0,1 + 0,1.2 = 0,3(mol)
Ag : 0,1 + 0,1.2 = 0,3(mol)
Fe + 2AgNO3 →Fe(NO3)2 + 2Ag
0,3.....0,3...............................0,3.........(mol)
Vậy :
m = (0,3 + 0,3).56 = 33,6 gam
V = \(\dfrac{0,3}{1}\) = 0,3(lít)
Cho m1 gam Al vào 100 ml dung dịch gồm Cu(NO3)2 0,3M và AgNO3 0,3M. Sau khi các phản ứng xảy ra hoàn toàn thì thu được m 2 gam chất rắn X. Nếu cho gam X tác dụng với lượng dư dung dịch HC1 thì thu được 0,672 lít khí (ở đktc). Giá trị của m1 và m2 lần lượt là
A. 1,08 và 5,43
B. 1,35 và 5,43
C. 1,35 và 5,70
D. 1,08 và 5,16
Chọn C
m2 gam X có thể phản ứng với HC1 tạo H2 Þ Có Al dư Þ nAl dư = 0,03/1,5 = 0,02
Vì AI dư Þ Toàn bộ Ag+ và Cu2+ đã bị khử hết về kim loại đơn chất
BTE Þ 3nAl phản ứng = 0,03x2 + 0,03 = 0,09 Þ nAl phản ứng = 0,03
Vậy m1 = (0,03 + 0,02)x27 = 1,35; m2 = 0,02x27 + 0,03x64 + 0,03x108 = 5,7
Cho m1 gam Al vào 100ml dung dịch gồm Cu(NO3)2 0,3M và AgNO3 0,3M. Sau khi các phản ứng xảy ra hoàn toàn thì thu được m2 gam chất rắn X, Nếu cho m2 gam X tác dụng với lượng dư dung dịch HCl thì thu được 0,336 lít khí (ở đktc). Giá trị của m1 và m2 là
A. 8,10 và 5,43
B. 1,08 và 5,43
C. 0,54 và 5,16
D. 1,08 và 5,16