Câu 6. Cho 0,27 gam kim loại A (hóa trị III) tác dụng vừa đủ với dd axit clohiđric (H và Cl), sau phản ứng thu được m gam muối clorua (A và Cl) và 336(ml) khí hiđro (đktc).a. Xác định tên kim loại A.b. Tính khối lượng muối clorua thu được.Câu 7. Đốt cháy 3,1 gam photpho trong bình chứa 4,48 lít khí oxi (đktc), sau phản ứng thu được a gam chất rắn.a. Chất nào còn dư sau phản ứng và dư bao nhiêu gam?b. Tính khối lượng của hợp chất thu được.c. Nếu hòa tan hết a gam hợp chất trên vào nước thì sau ph...
Đọc tiếp
Câu 6. Cho 0,27 gam kim loại A (hóa trị III) tác dụng vừa đủ với dd axit clohiđric (H và Cl), sau phản ứng thu được m gam muối clorua (A và Cl) và 336(ml) khí hiđro (đktc).
a. Xác định tên kim loại A.
b. Tính khối lượng muối clorua thu được.
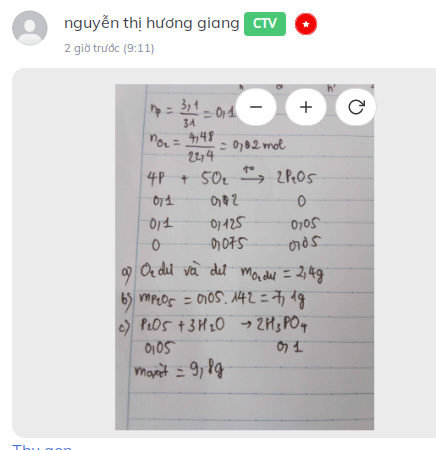
Câu 7. Đốt cháy 3,1 gam photpho trong bình chứa 4,48 lít khí oxi (đktc), sau phản ứng thu được a gam chất rắn.
a. Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b. Tính khối lượng của hợp chất thu được.
c. Nếu hòa tan hết a gam hợp chất trên vào nước thì sau phản ứng thu được sản phẩm là axit photphoric (H và PO4). Tính khối lượng axit có trong dung dịch thu được sau phản ứng?
Câu 8. Cho một lượng Mg tác dụng hết với dung dịch có chứa 19,6 gam H2SO4.
a. Tính khối lượng Mg đã phản ứng.
b. Tính khối lượng muối thu được sau phản ứng.
c. Dẫn toàn bộ lượng khí H2 thu được qua ống sứ chứa 24gam CuO nung nóng cho tới khi phản ứng xảy ra hoàn toàn. Tính khối lượng Cu thu được sau phản ứng.