Cho các nguyên tố sau:S(Z=16),P(Z=15),N(Z=7).So sánh tính chất hóa học cơ bản của chúng

Những câu hỏi liên quan
Cho các nguyên tố sau:S(Z=16),P(Z=15),N(Z=7).So sánh tính chất hóa học cơ bản của chúng
cho các nguyên tố Li(z=3), Ne(=10),Mg(=12),s(z=16).xác định tính chất hóa học cơ bản của các nguyên tố trên và các nguyên tố trên hình thành ion nào
Cho các nguyên tố A (Z= 12), B (Z= 18), D (Z= 16). Hãy cho biết:
a) Cấu hình electron nguyên tử của nguyên tố A, B, D.
b) Tính chất hóa học cơ bản của A, B, D.
c) Viết công thức hợp chất của nguyên tố D với hiđro, oxi và hiđroxit
14X : 1s22s22p63s23p2
Vị trí X trong BTH : ô số 14 , chu kỳ 3 ( vì có 3 lớp e ) ,nhóm IVA ( vì có 4e lớp ngoài cùng ).
b.
Hợp chất oxit cao nhất là SiO2 và hợp chất khí với hidro là SiH4
Bạn Tham khảo nha:
Đúng 1
Bình luận (0)
Nguyên tố atatin (Z = 85) thuộc chu kì 6, nhóm VIIA. Hãy dự đoán tính chất hóa học cơ bản của nó và so sánh với các nguyên tố khác trong nhóm.
Nguyên tố atatin (Z = 85) thuộc chu kì 6, nhóm VIIA nên có 85e phân bố thành 6 lớp, lớp ngoài cùng có 7e nên thể hiện tính phi kim. At ở cuối nhóm VIIA, nên tính phi kim yếu nhất trong nhóm.
Đúng 0
Bình luận (0)
Nguyên tố atatin At (Z = 85) thuộc chu kì 6, nhóm VIIA. Hãy dự đoán tính chất hóa học cơ bản của nó và so sánh với các nguyên tố khác trong nhóm.
Nguyên tố atatin (Z = 85) thuộc chu kì 6, nhóm VIIA nên có 85e phân bố thành 6 lớp, lớp ngoài cùng có 7e nên thể hiện tính phi kim. At ở cuối nhóm VIIA, nên tính phi kim yếu nhất trong nhóm.
Đúng 0
Bình luận (0)
Có các nguyên tố hóa học: Cr (Z = 24), Fe (Z = 26), P (Z = 15), Al (Z =13). Nguyên tố mà nguyên tử của nó có số electron độc thân lớn nhất ở trạng thái cơ bản là
A. P
B. Al
C. Cr
D. Fe
Chọn C
Cấu hình electron nguyên tử:
Cr (z = 24): [Ar]3d54s1 → 6 electron độc thân.
Fe (Z = 26): [Ar]3d64s2 → 4 electron độc thân.
P (z = 15): [Ne] 3s23p3 → 3 electron độc thân.
Al (z = 13): [Ne]3s23p1 → 1 electron độc thân.
Đúng 0
Bình luận (0)
Có các nguyên tố hóa học: Cr (Z = 24), Fe (Z = 26), P (Z = 15), Al (Z = 13). Nguyên tố mà nguyên tử của nó có số electron lớp ngoài cùng lớn nhất ở trạng thái cơ bản là
A. Al.
B. Fe.
C. Cr.
D. P.
Dựa vào vị trí của nguyên tố Mg (Z = 12) trong bảng tuần hoàn: So sánh tính chất hóa học của nguyên tố Mg (Z = 12) với Na (Z = 11) và Al (Z = 13).
Na: 1s22s22p63s1.
Mg: 1s22s22p63s2.
Al: 1s22s22p63s23p1.
- Có 1, 2, 3 electron ở lớp ngoài cùng nên đều là kim loại.
- Tính kim loại giảm dần theo chiều Na, Mg, Al.
- Tính bazơ giảm dần theo chiều NaOH, Mg(OH)2, Al(OH)3.
Đúng 0
Bình luận (0)
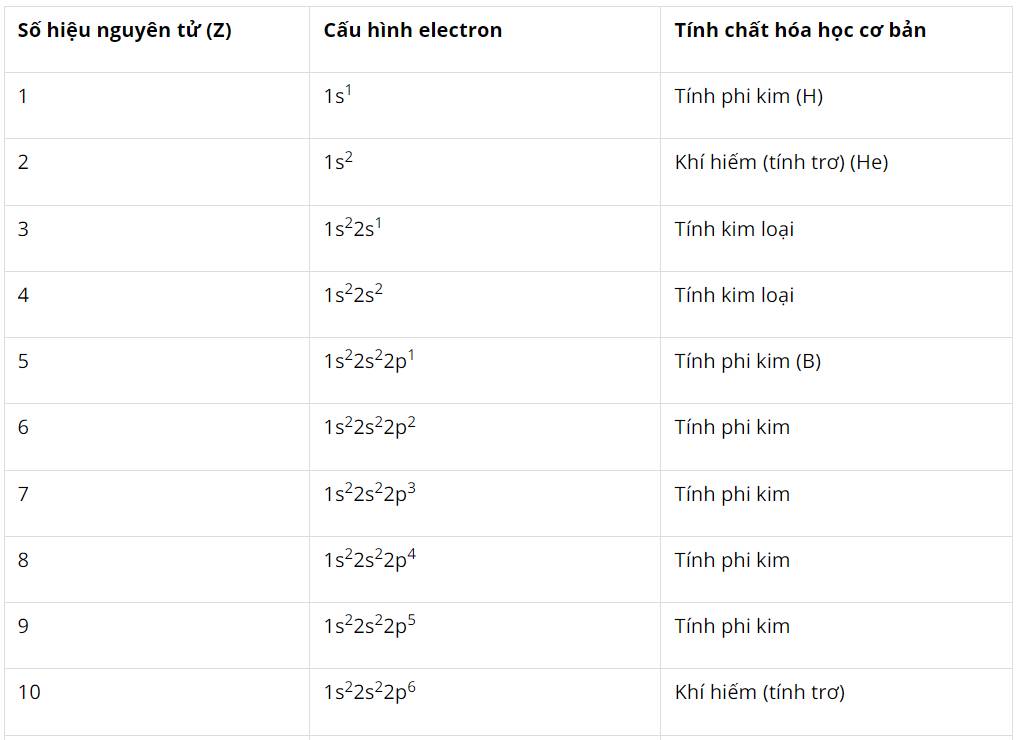
Dự đoán tính chất hóa học cơ bản (tính kim loại, tính phi kim) của các nguyên tố có Z từ 1 đến 20.