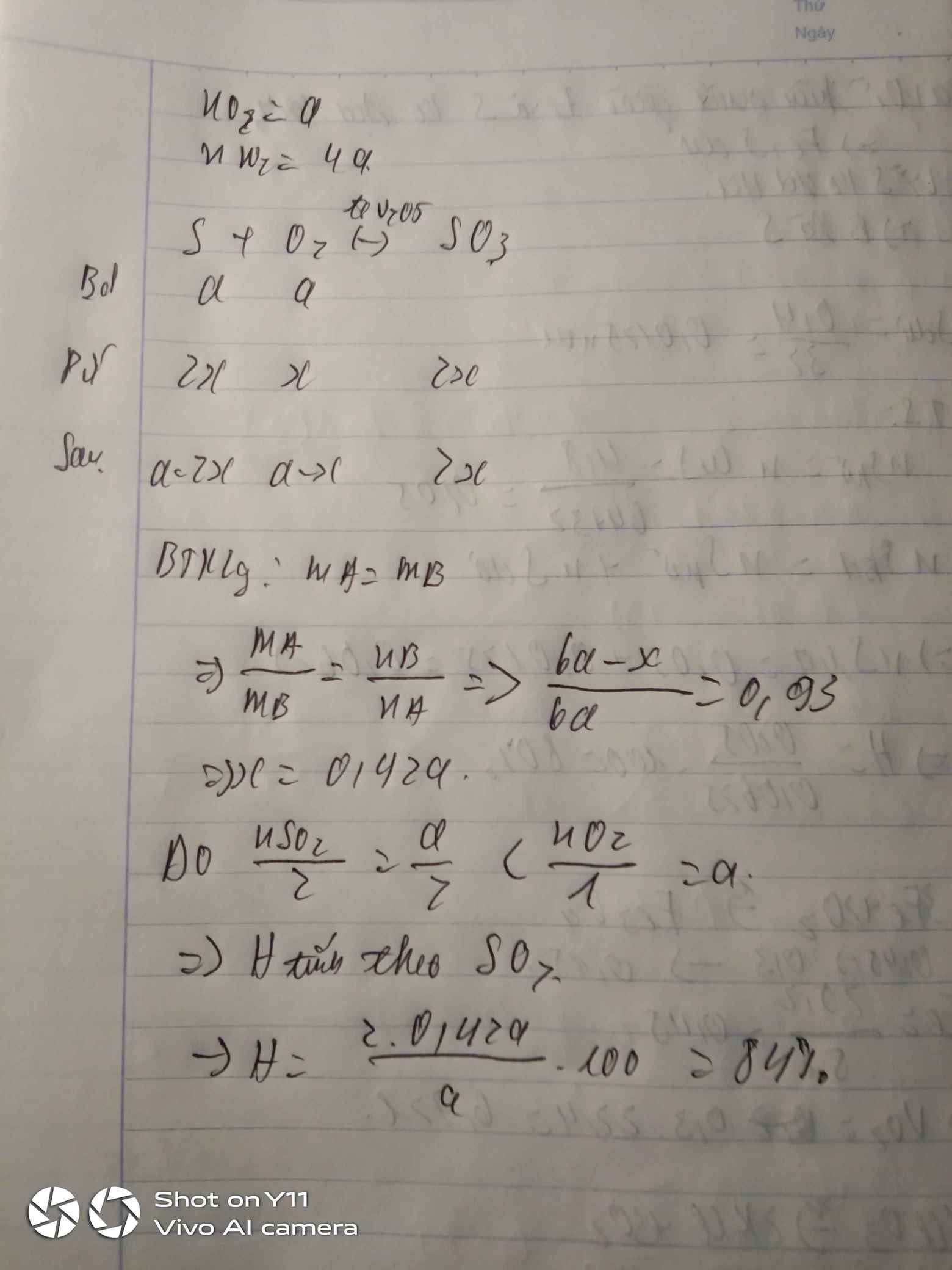nêu táC DỤNG của khí so2 với khí sì hơi =)

Những câu hỏi liên quan
Bài 1. a) Tính tỉ khối hơi của khí SO2 so với khí O2 N2, SO3, CO, N2O, NO2.b) Tính tỉ khối hơi của hỗn hợp khí A gồm SO2 và O2 có tỉ lệ mol 1:1 đối với khí O2.Bài 2. a) Tính tỉ khối hơi của hỗn hợp khí X gồm hai khí N2 và CO đối với khí metan CH4. Hỗn hợp X nặng hay nhẹ hơn không khí?b) Tính tỉ khối hơi của hỗn hợp Y đồng khối lượng gồm khí C2H4 (etilen), N2 và khí CO so với khí H2.c) Hỗn hợp khí X gồm: NO, NxO, CH4. Trong đó NO chiếm 30% về thể tích, NxO chiếm 30% còn lại là CH4. Trong hỗn hợp...
Đọc tiếp
Bài 1. a) Tính tỉ khối hơi của khí SO2 so với khí O2 N2, SO3, CO, N2O, NO2.
b) Tính tỉ khối hơi của hỗn hợp khí A gồm SO2 và O2 có tỉ lệ mol 1:1 đối với khí O2.
Bài 2. a) Tính tỉ khối hơi của hỗn hợp khí X gồm hai khí N2 và CO đối với khí metan CH4. Hỗn hợp X nặng hay nhẹ hơn không khí?
b) Tính tỉ khối hơi của hỗn hợp Y đồng khối lượng gồm khí C2H4 (etilen), N2 và khí CO so với khí H2.
c) Hỗn hợp khí X gồm: NO, NxO, CH4. Trong đó NO chiếm 30% về thể tích, NxO chiếm 30% còn lại là CH4. Trong hỗn hợp CH4 chiếm 22,377% về khối lượng. Xác định công thức hoá học của NxO. Tính tỷ khối của X so với không khí
Bài 2:
a) Vì khối lượng mol của N2 và CO đều bằng 28 và lớn hơn khối lượng mol của khí metan CH4 (28>16)
=> \(d_{\dfrac{hhX}{CH_4}}=\dfrac{28}{16}=1,75\)
Hỗn hợp X nhẹ hơn không khí (28<29)
b)
\(M_{C_2H_4}=M_{N_2}=M_{CO}=28\left(\dfrac{g}{mol}\right)\\ \rightarrow M_{hhY}=28\left(\dfrac{g}{mol}\right)\\ d_{\dfrac{Y}{H_2}}=\dfrac{28}{2}=14\)
c) \(\%V_{NO}=100\%-\left(30\%+30\%\right)=40\%\\ \rightarrow\%n_{CH_4}=40\%\\ Vì:\%m_{CH_4}=22,377\%\\ Nên:\dfrac{30\%.16}{40\%.30+30\%.16+30\%.\left(x.14+16\right)}=22,377\%\\ \Leftrightarrow x=-0,03\)
Sao lại âm ta, để xíu anh xem lại như nào nhé.
Đúng 2
Bình luận (4)
Bài 1:
\(a.\\ d_{\dfrac{SO_2}{O_2}}=\dfrac{64}{32}=2\\ d_{\dfrac{SO_2}{N_2}}=\dfrac{64}{28}=\dfrac{16}{7}\\ d_{\dfrac{SO_2}{SO_3}}=\dfrac{64}{80}=0,8\\ d_{\dfrac{SO_2}{CO}}=\dfrac{64}{28}=\dfrac{16}{7}\\ d_{\dfrac{SO_2}{N_2O}}=\dfrac{64}{44}=\dfrac{16}{11}\\ d_{\dfrac{SO_2}{NO_2}}=\dfrac{64}{46}=\dfrac{32}{23}\\ b.M_{hhA}=\dfrac{1.64+1.32}{1+1}=48\left(\dfrac{g}{mol}\right)\\ d_{\dfrac{hhA}{O_2}}=\dfrac{48}{32}=1,5\)
Đúng 4
Bình luận (2)
Hỗn hợp khí A gồm a mol SO2 và 5a mol không khí. Nung nóng hỗn hợp A với V2O5 xúc tác thu được hỗn hợp khí B. Biết rằng tỉ khối hơi của A so với B bằng 0,93. Hãy tính hiệu suất phản ứng giữa SO2 và O2. Cho không khí có chưa 80% N2 và 20% O2 theo thể tích.
giúp em nhanh với e tick nhanh cho ạ , em cảm ơn ạ
Hỗn hợp A ban đầu có SO2 : a mol, N2: 4a mol và O2: a mol.
Phản ứng:
2SO2 + O2< --> 2SO3 (XT: V2O5, t0) (1)
Gọi số mol SO2 phản ứng là x.
Theo (1): Số mol giảm = số mol O2 phản ứng = 0,5x mol
=> nB = 6a – 0,5x mol
Theo định luật bảo toàn khối lượng: mA = mB = m
\(d_{A/B}=\dfrac{m}{6a}:\dfrac{m}{6a-0,5x}=\dfrac{6a-0,5x}{6a}=0,93\)
\(\Rightarrow\dfrac{x}{a}=0,84\)
\(VậyH\%=84\%\)
Đúng 2
Bình luận (2)
hh A 12g gồm kim loại R và Mg tác dụng với hcl thu được 6,72l. mặt khác cho 12g hh A tác dụng với H2so4 thu được duy nhất khí so2. cho khí so2 này tác dụng với 1l naoh 1M , kết thúc phản ứng nồng độ của NaOh còn lại trong dung dịch là 0,25M. xác định kim loại R
Đề bài có đề cập gì đến hóa trị của R không bạn nhỉ? Ví dụ như R có hóa trị không đổi?
Đúng 0
Bình luận (0)
Trong các thí nghiệm sau : (1) Cho SiO2 tác dụng với axit HF. (2) Cho khí SO2 tác dụng với khí H2S. (3) Cho khí NH3 tác dụng với CuO đun nóng. (4) Cho CaOCl2 tác dụng với dung dịch HCl đặc. (5) Cho Si đơn chất tác dụng với dung dịch NaOH. (6) Cho khí O3 tác dụng với Ag. Số thí nghiệm tạo ra đơn chất là : A. 4 B. 5 C. 7 D. 6
Đọc tiếp
Trong các thí nghiệm sau :
(1) Cho SiO2 tác dụng với axit HF.
(2) Cho khí SO2 tác dụng với khí H2S.
(3) Cho khí NH3 tác dụng với CuO đun nóng.
(4) Cho CaOCl2 tác dụng với dung dịch HCl đặc.
(5) Cho Si đơn chất tác dụng với dung dịch NaOH.
(6) Cho khí O3 tác dụng với Ag.
Số thí nghiệm tạo ra đơn chất là :
A. 4
B. 5
C. 7
D. 6
Chọn B
(2) Cho khí SO2 tác dụng với khí H2S.
(3) Cho khí NH3 tác dụng với CuO đun nóng.
(4) Cho CaOCl2 tác dụng với dung dịch HCl đặc.
(5) Cho Si đơn chất tác dụng với dung dịch NaOH.
(6) Cho khí O3 tác dụng với Ag
Đúng 0
Bình luận (0)
Trong các thí nghiệm sau: (1) Cho SiO2 tác dụng với axit HF. (2) Cho khí SO2 tác dụng với khí H2S. (3) Cho khí NH3 tác dụng với CuO đun nóng. (4) Cho CaOCl2 tác dụng với dung dịch HCl đặc. (5) Cho Si đơn chất tác dụng với dung dịch NaOH. (6) Cho khí O3 tác dụng với Ag. Số thí nghiệm tạo ra đơn chất là A. 4 B. 6 C. 3 D. 5
Đọc tiếp
Trong các thí nghiệm sau:
(1) Cho SiO2 tác dụng với axit HF.
(2) Cho khí SO2 tác dụng với khí H2S.
(3) Cho khí NH3 tác dụng với CuO đun nóng.
(4) Cho CaOCl2 tác dụng với dung dịch HCl đặc.
(5) Cho Si đơn chất tác dụng với dung dịch NaOH.
(6) Cho khí O3 tác dụng với Ag.
Số thí nghiệm tạo ra đơn chất là
A. 4
B. 6
C. 3
D. 5
Chọn D
(2) Cho khí SO2 tác dụng với khí H2S.
(3) Cho khí NH3 tác dụng với CuO đun nóng.
(4) Cho CaOCl2 tác dụng với dung dịch HCl đặc.
(5) Cho Si đơn chất tác dụng với dung dịch NaOH.
(6) Cho khí O3 tác dụng với Ag
Đúng 0
Bình luận (0)
Trong các thí nghiệm sau:(1) Cho
SiO
2
tác dụng với axit
HF
. (2) Cho khí
SO
2
tác dụng với khí
H
2
S
.(3) Cho khí
NH
3
tác dụng với
CuO
đun nóng.(4) Cho
CaOCl
2
tác dụng với dung dịch
HCl
đặc.(5) Cho
Si
đ...
Đọc tiếp
Trong các thí nghiệm sau:
(1) Cho SiO 2 tác dụng với axit HF .
(2) Cho khí SO 2 tác dụng với khí H 2 S .
(3) Cho khí NH 3 tác dụng với CuO đun nóng.
(4) Cho CaOCl 2 tác dụng với dung dịch HCl đặc.
(5) Cho Si đơn chất tác dụng với dung dịch NaOH .
(6) Cho khí O 3 tác dụng với Ag .
Số thí nghiệm tạo ra đơn chất là
A. 4.
B. 6.
C. 3.
D. 5.
Đáp án D
5 thí nghiệm tạo ra đơn chất là (2), (3), (4), (5), (6).
Đúng 0
Bình luận (0)
Trong các thí nghiệm sau:(1) Cho SiO2 tác dụng với axit HF.(2) Cho khí SO2 tác dụng với khí H2S.(3) Cho khí NH3 tác dụng với CuO đun nóng.(4) Cho CaOCl2 tác dụng với dung dịch HCl đặc.(5) Cho Si đơn chất tác dụng với dung dịch NaOH.(6) Cho khí O3 tác dụng với Ag.Số thí nghiệm tạo ra đơn chất là A. 4. B. 6. C. 3. D. 5.
Đọc tiếp
Trong các thí nghiệm sau:
(1) Cho SiO2 tác dụng với axit HF.
(2) Cho khí SO2 tác dụng với khí H2S.
(3) Cho khí NH3 tác dụng với CuO đun nóng.
(4) Cho CaOCl2 tác dụng với dung dịch HCl đặc.
(5) Cho Si đơn chất tác dụng với dung dịch NaOH.
(6) Cho khí O3 tác dụng với Ag.
Số thí nghiệm tạo ra đơn chất là
A. 4.
B. 6.
C. 3.
D. 5.
Đáp án D
5 thí nghiệm tạo ra đơn chất là (2), (3), (4), (5), (6).
Đúng 0
Bình luận (0)
Trong các thí nghiệm sau :(1) Cho SiO2 tác dụng với axit HF(2) Cho khí SO2 tác dụng với khí H2S.(3) Cho khí NH3 tác dụng với CuO đun nóng.(4) Cho CaOCl2 tác dụng với dung dịch HCl đặc.(5) Cho Si đơn chất tác dụng với dung dịch NaOH.(6) Cho khí O3 tác dụng với Ag.Số thí nghiệm tạo ra đơn chất là : A. 4 B. 5 C. 7. D. 6.
Đọc tiếp
Trong các thí nghiệm sau :
(1) Cho SiO2 tác dụng với axit HF
(2) Cho khí SO2 tác dụng với khí H2S.
(3) Cho khí NH3 tác dụng với CuO đun nóng.
(4) Cho CaOCl2 tác dụng với dung dịch HCl đặc.
(5) Cho Si đơn chất tác dụng với dung dịch NaOH.
(6) Cho khí O3 tác dụng với Ag.
Số thí nghiệm tạo ra đơn chất là :
A. 4
B. 5
C. 7.
D. 6.
Cho 4,48 lít khí SO2 tác dụng với 2,24 lít khí O2. Thêm xúc tác và nung nóng cho phản ứng xảy ra. Sau khi phản ứng kết thúc, ta thu được 5,6 lít hỗn hợp khí gồm SO2, O2, SO3. Tính thể tích mỗi khí có trong hỗn hợp sau phản ứng và tính hiệu suất của phản ứng. Biết các khí đo ở đktc
Gọi hiệu suất phản ứng là a
$2SO_2 + O_2 \xrightarrow{t^o,V_2O_5} 2SO_3$
Ta thấy :
V SO2 / 2 = V O2 nên hiệu suất tính theo số mol của SO2 hoặc O2
V SO2 phản ứng = 4,48a(lít)
V O2 phản ứng = 2,24a(lít)
V SO3 = V SO2 pư = 4,48a(lít)
Sau phản ứng, khí gồm :
SO2 : 4,48 - 4,48a(lít)
O2 : 2,24 - 2,24a(lít)
SO3 : 4,48a(lít)
Suy ra :
4,48 - 4,48a + 2,24 - 2,24a + 4,48a = 5,6
=> a = 0,5 = 50%
Hỗn hợp khí gồm :
SO2 : 4,48 -4,48.0,5 = 2,24 lít
O2 : 2,24 - 2,24.0,5 = 1,12 lít
SO3 : 4,48.0,5 = 2,24 lít
Đúng 1
Bình luận (3)