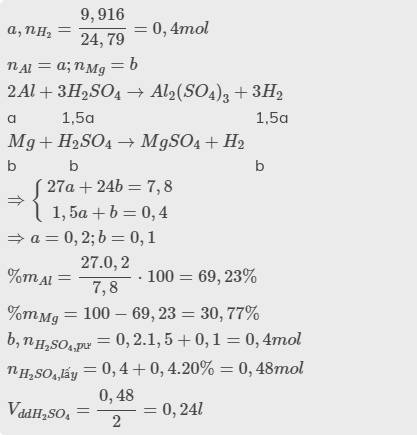Cho 7,8 gam hỗn hợp hai kim loại là Mg và Al tác dụng với dung dịch H 2 SO 4 loãng, dư. Khi phản ứng kết thúc, người ta thu được 8,96 lít khí (đktc). Viết PTHH của các phản ứng đã xảy ra.

Những câu hỏi liên quan
Cho 7,8 gam hỗn hợp hai kim loại là Mg và Al tác dụng với dung dịch H 2 SO 4 loãng, dư. Khi phản ứng kết thúc, người ta thu được 8,96 lít khí (đktc). Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu.
Khối lượng kim loại trong hỗn hợp:
- Số mol H 2 ở (1) và (2) n H 2 = 8,96/22,4 = 0,4 mol
- Đặt x và y là số mol Mg và Al có trong hỗn hợp. Từ (1) và (2) ta có hệ phương trình đại số :
x + 3/2y = 0,4
24x + 27y = 7,8
Giải hệ phương trình, ta được x = 0,1 và y = 0,2.
Khối lượng các kim loại :
m Mg = 0,1 x 24 = 2,4g
m Al = 0,2 x 27 = 5,4g
Đúng 1
Bình luận (0)
Câu 1 : 7,8 gam hỗn hợp gồm Mg và Al tác dụng với HCl dư, sau phản ứng thấy khối lượng dung dịch tăng thêm 7 gam. Tìm % khối lượng mỗi kim loại ? Cau 2: Cho m gam hỗn hợp X gồm Mg và Fe tác dụng vừa đủ với 2 lít dung dịch HCl 0,35M, cô cạn dung dịch sau phản ứng thì thu được 39,65 gam muối khan.a - Tính % khối lượng mỗi kim loại trong hỗn hợp X.b - Tính thể tích khí hidro thu được (đktc).giúp em gấp 2 câu này với ạ.
Đọc tiếp
Câu 1 : 7,8 gam hỗn hợp gồm Mg và Al tác dụng với HCl dư, sau phản ứng thấy khối lượng dung dịch tăng thêm 7 gam. Tìm % khối lượng mỗi kim loại ?
Cau 2: Cho m gam hỗn hợp X gồm Mg và Fe tác dụng vừa đủ với 2 lít dung dịch HCl 0,35M, cô cạn dung dịch sau phản ứng thì thu được 39,65 gam muối khan.
a - Tính % khối lượng mỗi kim loại trong hỗn hợp X.
b - Tính thể tích khí hidro thu được (đktc).
giúp em gấp 2 câu này với ạ.
Câu 2. Cho 7,8 g hỗn hợp Mg và Al tác dụng với dung dịch H,SO, loãng dư, thu được 9,916 L khi (đkc).
a, Tính phần trăm về khối lượng mỗi kim loại trong hỗn hợp ban đầu.
b, Tinh thể tích dung dịch H,SO, 2M đã dùng, biết lấy dư 20% so với lượng cần dùng.
Câu 2. Cho 7,8 g hỗn hợp Mg và Al tác dụng với dung dịch H,SO, loãng dư, thu được 9,916 L khi (đkc).
a, Tính phần trăm về khối lượng mỗi kim loại trong hỗn hợp ban đầu.
b, Tinh thể tích dung dịch H,SO, 2M đã dùng, biết lấy dư 20% so với lượng cần dùng.
\(a,n_{H_2}=\dfrac{9,916}{24,79}=0,4mol\\ n_{Al}=a;n_{Mg}=b\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
a 1,5a 1,5a
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
b b b
\(\Rightarrow\left\{{}\begin{matrix}27a+24b=7,8\\1,5a+b=0,4\end{matrix}\right.\\ \Rightarrow a=0,2;b=0,1\\ \%m_{Al}=\dfrac{27.0,2}{7,8}\cdot100=69,23\%\\ \%m_{Mg}=100-69,23=30,77\%\\ b,n_{H_2SO_4,pư}=0,2.1,5+0,1=0,4mol\\ n_{H_2SO_4,lấy}=0,4+0,4.20\%=0,48mol\\ V_{ddH_2SO_4}=\dfrac{0,48}{2}=0,24l\)
Đúng 1
Bình luận (0)
Cho 7,8 gam hỗn hợp hai kim loại là Mg và Al tác dụng với dung dịch
H
2
SO
4
loãng, dư. Khi phản ứng kết thúc, người ta thu được 8,96 lít khí (đktc). Tính thể tích dung dịch
H
2
SO
4
2M đã tham gia các phản ứng.
Đọc tiếp
Cho 7,8 gam hỗn hợp hai kim loại là Mg và Al tác dụng với dung dịch H 2 SO 4 loãng, dư. Khi phản ứng kết thúc, người ta thu được 8,96 lít khí (đktc). Tính thể tích dung dịch H 2 SO 4 2M đã tham gia các phản ứng.
Thể tích dung dịch H 2 SO 4 tham gia phản ứng :
Số mol H 2 SO 4 tham gia (1) và (2) là :
0,1 + 0,3 = 0,4 (mol)
Thể tích dung dịch H 2 SO 4 là :
V H 2 SO 4 = 0,4/2 = 0,2 l
Đúng 0
Bình luận (0)
Cho 7,8 g hỗn hợp hai kim loại Al và Mg, tác dụng vừa đủ với 200g dung dịch H2SO4 19,6%
a) Tính khối lượng mỗi kim loại trong hỗn hợp
b)Tính nồng độ phần trăm của các dung dịch sau phản ứng
GIÚP MK NHANH VỚI Ạ
PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
2a______3a__________a_______3a (mol)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
b_______b________b______b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}27\cdot2a+24b=7,8\\3a+b=\dfrac{200\cdot19,6\%}{98}=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,1\cdot24=2,4\left(g\right)\\m_{Al}=5,4\left(g\right)\\n_{Al_2\left(SO_4\right)_3}=0,1\left(mol\right)=n_{MgSO_4}\\n_{H_2}=0,4\left(mol\right)\Rightarrow m_{H_2}=0,4\cdot2=0,8\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{KL}+m_{ddH_2SO_4}-m_{H_2}=207\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,1\cdot342}{207}\cdot100\%\approx16,52\%\\C\%_{MgSO_4}=\dfrac{0,1\cdot120}{207}\cdot100\%\approx5,8\%\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Cho 7,8 gam hỗn hợp hai kim loại Mg và Al tác dụng với dung dịch H2SO4 loãng dư. Khi phản ứng kết thúc người ta thu được 8,96 lít khí (đktc).
a. Viết các phương trình hoá học xảy ra
b. Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu.
c. Tính thể tích dung dịch H2SO4 2 M đã tham gia phản ứng
a)
2Al + 3H2SO4 → Al2(SO4)3 +3H2
Mg + H2SO4 → MgSO4 + H2
b. n H2 = 8,96/22,4 =0,4 mol
Gọi x và y là số mol của Al và Mg ta có hệ
27x+ 24y = 7,8 (1)
1,5x+ y = 0,4 (2)
Từ 1 và 2 => x = 0,2 ; y = 0,1
Khối lượng của Al và Mg là:
mAg = 0,2.27=5,4(gam)
mMg = 7,8 – 5,4 = 2,4(gam)
c. Theo phương trình số mol của H2SO4 là : 0,3 + 0,1 = 0,4(mol)
Thể tích dung dịch H2SO4 2M đã tham gia phản ứng là:
V = 0,4/2=0,2 lít
Đúng 3
Bình luận (1)
Gọi nMg = a (mol); nAl = b (mol)
=> 24a + 27b = 7,8 (1)
nH2 = 8,96/22,4 = 0,4 (mol)
PTHH:
Mg + H2SO4 -> MgSO4 + H2
a ---> a ---> a ---> a
2Al + 3H2SO4 -> 2Al2(SO4)3 + 3H2
b ---> 1,5b ---> b ---> 1,5b
=> a + 1,5b = 0,4 (2)
(1)(2) => a = 0,1 (mol); b = 0,2 (mol)
mMg = 0,1 . 24 = 2,4 (g)
mAl = 0,2 . 27 = 5,4 (g)
nH2SO4 = 0,1 + 0,3 . 1,5 = 0,4 (mol)
VddH2SO4 = 0,3/2 = 0,2 (l)
Đúng 4
Bình luận (7)
a.b.\(n_{H_2}=\dfrac{8,96}{22,4}=0,4mol\)
Gọi \(\left\{{}\begin{matrix}n_{Mg}=x\\n_{Al}=y\end{matrix}\right.\)
\(Mg+H_2SO_4\left(l\right)\rightarrow MgSO_4+H_2\)
x x ( mol )
\(2Al+3H_2SO_4\left(l\right)\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
y 3/2y ( mol )
Ta có:
\(\left\{{}\begin{matrix}24x+27y=7,8\\x+\dfrac{3}{2}y=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\Rightarrow m_{Mg}=0,1.24=2,4g\)
\(\Rightarrow m_{Al}=0,2.27=5,4g\)
c.\(Mg+H_2SO_4\left(l\right)\rightarrow MgSO_4+H_2\)
0,1 0,1 ( mol )
\(2Al+3H_2SO_4\left(l\right)\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,3 ( mol )
\(V=\dfrac{n}{C_{M\left(H_2SO_4\right)}}=\dfrac{0,1+0,3}{2}=0,2l\)
Đúng 3
Bình luận (1)
Xem thêm câu trả lời
Cho 7,8 g hỗn hợp hai kim loại Al và Mg, tác dụng vừa đủ với 200g dung dịch H2SO4 19,6%
a) Tính khối lượng mỗi kim loại trong hỗn hợp
b)Tính nồng độ phần trăm của các dung dịch sau phản ứng
GIÚP MK NHANH VỚI Ạ
\(m_{H_2SO_4}=\frac{200.19,6}{100}=39,2g\)
\(\rightarrow n_{H_2SO_4}=\frac{39,2}{98}=0,4mol\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
x x x x
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
y 1,5y 0,5y 1,5y
Đặt \(\hept{\begin{cases}x\left(mol\right)=Mg\\y\left(mol\right)=Al\end{cases}}\)
a. Có hệ phương trình là: \(\hept{\begin{cases}24x+27y=7,8\\x+1,5y=0,4\end{cases}}\)
\(\rightarrow\hept{\begin{cases}x=0,1\\y=0,2\end{cases}}\)
\(m_{Mg}=0,1.24=2,4g\)
\(m_{Al}=7,8-2,4=5,4g\)
b. \(n_{H_2}=0,1+1,5.0,2=0,4mol\)
\(\rightarrow m_{H_2}=0,4.2=0,8g\)
\(m_{ddsaupu}=m_{hh}+m_{ddH_2SO_4}-m_{H_2}\)
\(\rightarrow m_{ddsaupu}=7,8+200-0,8=207g\)
Những dung dịch thu được sau phản ứng: \(MgSO_4;Al_2\left(SO_4\right)_3\)
\(m_{MgSO_4}=0,1.\left(24+32+16.4\right)=12g\)
\(\rightarrow C\%_{MgSO_4}=\frac{12.100}{207}=5,8\%\)
\(m_{Al_2\left(SO_4\right)_3}=0,5.0,2.\left(27.2+32.3+16.12\right)=34,2g\)
\(\rightarrow C\%_{Al_2\left(SO_4\right)_3}=\frac{34,2.100}{207}=16,52\%\)
Câu 1: Cho 2,58 gam hỗn hợp Mg, Al tác dụng vừa đủ với V dung dịch H2SO4 0,5M loãng thu được 2,91362 lít khí H2 (đktc). Tính khối lượng mỗi kim loại trong hỗn hợp đầu và giá trị VCâu 2: Cho 4,96 gam hỗn hợp Fe, Mg tác dụng vừa đủ với 200 gam dung dịch H2SO4 loãng a% thu được 3,136 lít khí H2 (đktc). Tính khối lượng mỗi kim loại trong hỗn hợp đầu và giá trị aCâu 3: Cho 3,94 gam hỗn hợp Ba, Mg tác dụng vừa đủ với 100ml dung dịch H2SO4 xM loãng thu được 1,568 lít khí H2 (đktc). Tính khối lượng mỗi...
Đọc tiếp
Câu 1: Cho 2,58 gam hỗn hợp Mg, Al tác dụng vừa đủ với V dung dịch H2SO4 0,5M loãng thu được 2,91362 lít khí H2 (đktc). Tính khối lượng mỗi kim loại trong hỗn hợp đầu và giá trị V
Câu 2: Cho 4,96 gam hỗn hợp Fe, Mg tác dụng vừa đủ với 200 gam dung dịch H2SO4 loãng a% thu được 3,136 lít khí H2 (đktc). Tính khối lượng mỗi kim loại trong hỗn hợp đầu và giá trị a
Câu 3: Cho 3,94 gam hỗn hợp Ba, Mg tác dụng vừa đủ với 100ml dung dịch H2SO4 xM loãng thu được 1,568 lít khí H2 (đktc). Tính khối lượng mỗi kim loại trong hỗn hợp đầu và giá trị x
Câu 1:
\(n_{H_2}=\dfrac{2.91362}{22.4}=0.13mol\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
a a a a
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
2b 3b b 3b
Ta có: \(\left\{{}\begin{matrix}24a+54b=2.58\\a+3b=0.13\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0.04\\b=0.03\end{matrix}\right.\)
\(m_{Mg}=0.04\times24=0.96g\)
\(m_{Al}=0.03\times2\times27=1.62g\)
\(V_{H_2SO_4}=\dfrac{0.04+3\times0.03}{0.5}=0.26l\)
Câu 2:
\(n_{H_2}=\dfrac{3.136}{22.4}=0.14mol\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
a a a a
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b b b b
Ta có: \(\left\{{}\begin{matrix}24a+56b=4.96\\a+b=0.14\end{matrix}\right.\)\(\Leftrightarrow\left\{{}\begin{matrix}a=0.09\\b=0.05\end{matrix}\right.\)
\(m_{Mg}=0.09\times24=2.16g\)
\(m_{Fe}=0.05\times56=2.8g\)
\(C\%_{H_2SO_4}=\dfrac{0.14\times98\times100}{200}=6.86\%\)
Đúng 0
Bình luận (0)
Câu 3:
\(n_{H_2}=\dfrac{1.568}{22.4}=0.07mol\)
\(Ba+H_2SO_4\rightarrow BaSO_4+H_2\)
a a a a
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
b b b b
Ta có: \(\left\{{}\begin{matrix}137a+24b=3.94\\a+b=0.07\end{matrix}\right.\)\(\Leftrightarrow\left\{{}\begin{matrix}a=0.02\\b=0.05\end{matrix}\right.\)
\(m_{Ba}=0.02\times137=2.74g\)
\(m_{Mg}=0.05\times24=1.2g\)
\(CM_{H_2SO_4}=\dfrac{0.07}{0.1}=0.7M\)
Đúng 0
Bình luận (0)