Ở điều kiện tiêu chuẩn, 2 lít hiđrocacbon A có khối lượng bằng 1 lít khí oxi. Hãy xác định công thức phân tử của A.

Những câu hỏi liên quan
Ở điều kiện tieu chuẩn, 2 lít hiđrocacbon khí (Z) có khối lượng bằng 1 lít oxi. Công thức phân tử của (Z) là: A. CH4O B. C3H8 C. C4H10O C. C3H8O
Đọc tiếp
Ở điều kiện tieu chuẩn, 2 lít hiđrocacbon khí (Z) có khối lượng bằng 1 lít oxi. Công thức phân tử của (Z) là:
A. CH4O B. C3H8 C. C4H10O C. C3H8O
Ở điều kiện tieu chuẩn, 2 lít hiđrocacbon khí (Z) có khối lượng bằng 1 lít oxi. Công thức phân tử của (Z) là:
A. CH4O B. C3H8 C. C4H10O C. C3H8O
Đúng 1
Bình luận (2)
Cho hợp chất hữu cơ a ở thể khí đốt cháy hoàn toàn 5,6 lít khí A ở điều kiện tiêu chuẩn thu được 22 gam CO2 và 9 gam nước. xác định công thức hóa học của phân tử là biết một lít khí A ở điều kiện tiêu chuẩn có khối lượng là 1,25 g
do hỗn hợp thu đc chỉ có CO2 và H2O => ct CxHy mà nCO2=O,5 mol , nH2O=0,5mol,=>đó là anken CnH2n
na=0,25 mol . áp dụng bảo toàn nguyên tố ooxxi t có nO2=(2nCO2+nH2O)/2=0.75mol
bảo toàn khối lượng => mhh=mCO2+mH2O-mO2=7g
=>Mhh=28 =>anken chính là C2H4
Đúng 0
Bình luận (1)
minh hoc lop 9. định luật nay chua hoc ạ
Đúng 0
Bình luận (1)
nếu hk tới laoij bài toán này rồi thì phải hk mấy định luật bảo toàn nguyên tố bỏa toàn khối lương rồi chứ nhỉ.
chị học bách khoa hà nội khoa hóa nhé
Đúng 0
Bình luận (1)
Xem thêm câu trả lời
Hai chất hữu cơ A và B có cùng công thức phân tử. Khi đốt cháy 2,9 gam A thu được 8,8 gam khí
CO
2
và 4,5 gam
H
2
O
. Ở điều kiện tiêu chuẩn 2,24 lít khí B có khối lượng 5,8 gam. Hãy xác định công thức phân tử của A, B và viết công thức cấu tạo của mỗi chất.
Đọc tiếp
Hai chất hữu cơ A và B có cùng công thức phân tử. Khi đốt cháy 2,9 gam A thu được 8,8 gam khí CO 2 và 4,5 gam H 2 O . Ở điều kiện tiêu chuẩn 2,24 lít khí B có khối lượng 5,8 gam. Hãy xác định công thức phân tử của A, B và viết công thức cấu tạo của mỗi chất.
Ta có M B = 5,8/22,4 x 22,4 = 58(gam/mol)
- Vì A, B có cùng công thức phân tử nên: M B = M A = 58(gam/mol)
- Trong 8,8 gam CO 2 có 8,8/44 x 12 = 2,4g cacbon
Trong 4,5 gam H 2 O có 4,5/18 x 2 = 0,5g hidro
Ta có m C + m H = 2,4 + 0,5 = 2,9g
m A = m C + m H . Vậy A và B là hai hidrocacbon có M A = 58 (gam/mol)
Vậy công thức phân tử của A,B là C 4 H 10 (xem cách giải bài số 34.5)
Công thức cấu tạo của hai chất A và B là
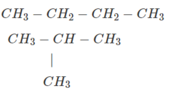
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 1,12 lít hỗn hợp khí X gồm ankin A và hiđrocacbon B thu được 2,912 lít CO2 và 2,52 gam H2O. Xác định công thức phân tử, viết công thức cấu tạo và gọi tên A, B. Biết rằng các thể tích khí đo ở điều kiện tiêu chuẩn
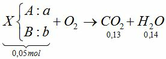
Đốt cháy ankin => nCO2 > nH2O mà theo bài ra nCO2 < nH2O
=> B là ankan nCO2 < nH2O
Nhận xét:
Đốt ankin: – nankin = nH2O – nCO2
Đốt ankan: nankan = nH2O – nCO2
=> b – a = 0,01 và b + a = 0,05
=> a = 0,02 và b = 0,03
=> số C trung bình = 2,6 và số H trung bình = 5,6
TH1: số C trong ankin < 2,6 => A là C2H2: 0,02 và B: 0,03
=> B: 44 (C3H8)
TH2: số C trong ankan < 2,6 => A : 0,02 và CH4: 0,03
=> A: 68 (C5H8) loại do hh khí
TH3: số C trong ankan < 2,6 => A: 0,02 và C2H6: 0,03
=> A: 47 (lẻ) => loại
Vậy A là C2H2 (axetilen/ etin) và B là C3H8 (propan)
Đúng 0
Bình luận (0)
Một oxi của nitơ (X) ở điều kiện tiêu chuẩn có khối lượng riêng bằng 2,054 gam/lít. Công thức phân tử của oxit là:
A. N 2 O
B. NO
C. N 2 O 3
D. M X
Ta có: M X = 2,054 x 22,4 = 46 (gam)
Gọi công thức oxit (X): N x O y
Theo đề: M X = 14x + 16y = 46
Nghiệm hợp lý: x=1, y=2 → CTHH: NO 2
Chọn D
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn hợp chất NxOy cần dùng vừa đủ 4.48 lít oxi ở điều kiện tiêu chuẩn, sau phản ứng thu được 14,8 lít N02. Biết hợp chất NxOy có tỉ khối với không khí là : 1,0344. Xác định công thức phân tử của NxOy
Một hợp chất hidrocacbon A có thành phần khối lượng gồm 92.3%C
a) Xác định công thức phân tử của A biết rằng ở điều kiện tiêu chuẩn 1 lít khí A có khối lượng =1.16g
b)Đốt cháy hoàn toàn 4.2g hỗn hợp X gồm 0.1 mol A và một hidrocacbon B khác A thu được 6.72 lít khí Co2 đo ở đktc.Xác định công thức phân tử của B
Đốt cháy 5,6 lít khí hiđrocacbon tạo thành 16,8 lít CO2 và 13,5 gam H2O các thể tích khí ở điều kiện tiêu chuẩn Tìm công thức phân tử và công thức cấu tạo của hiđrocacbon trên
Xem chi tiết
\(n_X=\dfrac{5.6}{22.4}=0.2\left(mol\right)\)
\(n_{CO_2}=\dfrac{16.8}{22.4}=0.75\left(mol\right)\)
\(n_{H_2O}=\dfrac{13.5}{18}=0.75\left(mol\right)\)
\(CT:C_xH_y\)
\(x=\dfrac{0.75}{0.25}=3\)
\(y=\dfrac{0.75\cdot2}{0.25}=6\)
\(CT:C_3H_6\)
\(CH_2=CH-CH_3\)
Đúng 3
Bình luận (0)
nCO2=0,75(mol) -> nC=0,75(mol)
nH2O=0,75(mol) -> nH=1,5(mol)
n(hidrocacbon)=0,25(mol)
Gọi CTTQ là CxHy (x,y: nguyên, dương)
x=0,75:0,25=3; y=1,5:0,25=6
=> CTPT là C3H6.
CTCT: \(CH_2=CH-CH_3\)
Đúng 1
Bình luận (0)
Đốt cháy 6,6 gam hợp chất chất hữu cơ A thu được 10,8 gam nước 11,1555 lít khí CO2 ở điều kiện chuẩn. Hãy xác định công thức phân tử của A, biết khối lượng mol của A là 44gam/ mol
\(n_{H_2O}=\dfrac{10,8}{18}=0,6\left(mol\right)\Rightarrow n_H=0,6.2=1,2\left(mol\right)\)
\(n_{CO_2}=\dfrac{11,1555}{24,79}=0,45\left(mol\right)=n_C\)
⇒ mC + mH = 0,45.12 + 1,2.1 = 6,6 (g) = mA
→ A chỉ gồm C và H.
Gọi: CTPT của A là CxHy.
⇒ x:y = 0,45:1,2 = 3:8
→ A có CTPT dạng (C3H8)n
\(\Rightarrow n=\dfrac{44}{12.3+1.8}=1\)
Vậy: CTPT của A là C3H8.
Đúng 2
Bình luận (0)


















