Qua thí nghiệm ở hình vẽ 3.4, em hãy viết phương trình hoá học của phản ứng xảy ra. Phản ứng hoá học này thuộc loại phản ứng nào ?

Những câu hỏi liên quan
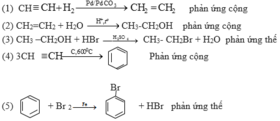
Viết phương trình hoá học của các phản ứng xảy ra theo sơ đồ sau:
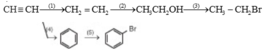
Trong các phản ứng trên, phản ứng nào thuộc loại phản ứng thế, phản ứng cộng, phản ứng tách?
Thí nghiệm ở hình 2.13(SGK) chứng minh khả năng bốc cháy khác nhau của P trắng và P đỏ. Hãy quan sát, mô tả và giải thích hiện tượng xảy ra trong thí nghiệm. Viết phương trình hoá học của phản ứng xảy ra?
P đỏ được đặt trên thanh sắt gần ngọn lửa hơn P trắng (to cao hơn). Hiện tượng: P trắng bốc cháy còn P đỏ thì không. Chứng tỏ P trắng dễ phản ứng với oxi hơn P đỏ rất nhiều. Thực tế P trắng có thể bị oxi hoá trong không khí ở nhiệt độ thường (hiện tượng phát quang hoá học), còn P đỏ thì bốc cháy khi đun nóng ở nhiệt độ 250oC.
4P +5O2 → 2P2O5
Đúng 0
Bình luận (0)
Tiến hành Thí nghiệm 2, quan sát hiện tượng ở hai ống nghiệm (1) và (2). Viết phương trình hoá học của phản ứng xảy ra ở Bước 2.

Hiện tượng: Cả 2 ống nghiệm đều xuất hiện kết tủa xanh lam nhạt (Cu(OH)2)
PTHH: CuSO4 + 2 NaOH → Cu(OH)2↓(xanh) + Na2SO4 (PTHH ở bước 2)
- Khi cho gylycerol vào ống 1: Kết tủa tan tạo thành dung dịch màu xanh lam của muối copper(II) glycerate
PTHH: 2 C3H5(OH)3 + Cu(OH)2→ [C3H5(OH)2O]2Cu + 2 H2O
- Khi cho ethanol vào ống 2: không có hiện tượng, kết tủa không tan.
Đúng 1
Bình luận (0)
Hiện tượng
-Khi cho vào hai ống nghiệm dung dịch CuSO4 thì sẽ xuất hiện kết tủa màu xanh lam
-Khi cho vào ống 1 glyxerol thì sẽ làm cho kết tủa tan dần tạo dần thành dung dịch màu xanh lam
-Khi cho etanol vào ống 2 thì kết tủa sẽ ko tan
PTHH:
\(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2\downarrow+Na_2SO_4\)
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm, người ta đã dùng cacbon oxit CO để khử 0,2 mol
F
e
3
O
4
và dùng khí hidro để khử 0,2 mol
F
e
2
O
3
ở nhiệt độ cao. a. Viết phương trình hoá học của các phản ứng đã xảy rab. Tính số lít khí CO và
H
2
ở đktc cần dùng cho mỗi phản ứng.c. Tính số gam sắt thu được ở mỗi phản ứng hoá học.
Đọc tiếp
Trong phòng thí nghiệm, người ta đã dùng cacbon oxit CO để khử 0,2 mol F e 3 O 4 và dùng khí hidro để khử 0,2 mol F e 2 O 3 ở nhiệt độ cao.
a. Viết phương trình hoá học của các phản ứng đã xảy ra
b. Tính số lít khí CO và H 2 ở đktc cần dùng cho mỗi phản ứng.
c. Tính số gam sắt thu được ở mỗi phản ứng hoá học.
Tiến hành Thí nghiệm 1 theo hướng dẫn. Nêu hiện tượng xảy ra. Giải thích và viết phương trình hoá học của phản ứng.

Tham khảo:
- Khi nhỏ vài giọt dung dịch acetic acid lên mẩu giấy quỳ tím, mẩu quỳ tím hóa đỏ vì acetic acid có tính acid.
- Khi cho vào ống nghiệm thứ nhất chứa dung dịch acetic acid vài mẩu magnesium, mẩu magnesium tan và xuất hiện bọt khí.
→ Giải thích: Acetic acid phản ứng với magnesium, làm magnesium tan và tạo khí hydrogen.
2CH3COOH + Mg → 2(CH3COO)2Mg + H2↑
- Khi cho vào ống nghiệm thứ hai chứa acetic acid 1 thìa sodium carbonate, sodium carbonate tan và xuất hiện bọt khí.
→ Giải thích: Acetic acid phản ứng với sodium carbonate, sinh ra khí carbon dioxide.
2CH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2↑
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm, người ta dùng hidro để khử sắt (III) oxit và thu được 11,2 gam sắt.
Viết phương trình hoá học của phản ứng đã xảy ra.
Tính khối lượng sắt(III) oxit đã phản ứng.
Tính thể tích khí hidro đã tiêu thụ (ở đktc).
Câu 12: Hãy nêu hiện tượng và viết PTHH xảy ra ở thí nghiệm Copper(II) oxide phản ứng với dung dịch HCl. Nếu thay dung dịch HCl bằng dung dịch H2SO4 thì có phản ứng hoá học xảy ra không? Giải thích?
Cả hai phản ứng đều làm cho CuO tan, tạo dung dịch xanh lam
\(CuO+2HCl->CuCl_2+H_2O\\ CuO+H_2SO_4->CuSO_4+H_2O\)
Đúng 3
Bình luận (0)
Thí nghiệm nào không xảy ra phản ứng hoá học?
A. Cho axit axetic vào dung dịch natri phenolat.
B. Cho nước brom vào axit fomic.
C. Cho axit axetic vào phenol (C6H5OH).
D. Cho dung dịch axit axetic vào đồng(II) hiđroxit.
Trong dung dịch, giữa các cặp chất nào sau đây có xảy ra phản ứng? Viết phương trình hoá học của các phản ứng đó.
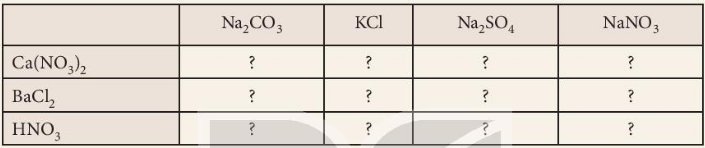
| Na2CO3 | KCl | Na2SO4 | NaNO3 | |
| Ca(NO3)2 | Có phản ứng (1) | Không phản ứng | Có phản ứng (2) | Không phản ứng |
| BaCl2 | Có phản ứng (3) | Không phản ứng | Có phản ứng (4) | Không phản ứng |
| HNO3 | Có phản ứng (5) | Không phản ứng | Không phản ứng | Không phản ứng |
Các PTHH:
\(\left(1\right)Ca\left(NO_3\right)_2+Na_2CO_3\rightarrow2NaNO_3+CaCO_3\downarrow\\ \left(2\right)Na_2SO_4+Ca\left(NO_3\right)_2\rightarrow CaSO_4+2NaNO_3\\ \left(3\right)Na_2CO_3+BaCl_2\rightarrow BaCO_3+2NaCl\\ \left(4\right)Na_2SO_4+BaCl_2\rightarrow BaSO_4+2NaCl\\ \left(5\right)2HNO_3+Na_2CO_3\rightarrow2NaNO_3+CO_2+H_2O\)
Đúng 1
Bình luận (0)