Hòa tan hết cùng 1 lượng Fe trong dd H2SO4 loãng(1) , và H2SO4 đặc nóng (2) thì thể tích khí sinh ra trong cùng điều kiện là
A. A (1) bằng (2)
B. B (1) gấp đôi (2)
C. C (2) gấp rưỡi (1)
D. D (2) gấp ba (1)
Hòa tan hết cùng 1 lượng Fe trong dd H2SO4 loãng(1), và H2SO4 đặc nóng (2) thì thể tích khí sinh ra trong cùng điều kiện là:
A. (1) bằng (2)
B. (1) gấp đôi (2)
C. (2) gấp rưỡi (1)
D. (2) gấp ba (1)
Đáp án C
Hòa tan hết cùng 1 lượng Fe (x mol) trong dung dịch H2SO4 loãng(1) và H2SO4 đặc, nóng (2):
Fe + H2SO4 → FeSO4 + H2↑
→ VH2 = 22,4x lít.
2Fe + 6H2SO4 đ 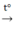 Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 3SO2 + 6H2O
VSO2 = 3/2.x.22,4 = 33,6l
=> Thể tích khí sinh ra trong cùng điều kiện (2) gấp rưỡi (1)
Hoà tan hết cùng một lượng Fe trong dung dịch H 2 S O 4 loãng (dư) và dung dịch H 2 S O 4 đặc, nóng (dư) thì các thế tích khí sinh ra lần lượt là V 1 , V 2 (đo ở cùng điều kiện). Liên hệ giữa V 1 , V 2 là
A. V 1 = V 2
B. V 1 = 2 V 2
C. V 2 = 1 , 5 V 1
D. V 2 = 3 V 1
Hòa tan hết a gam Fe trong dung dịch H2SO4 loãng thì sinh ra 3,36 lít khí (đktc). Nếu cho 1,25a gam Fe này vào lượng dư dung dịch H2SO4 đặc nóng thì thể tích khí sunfurơ sinh ra là
\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(0.15.................................0.15\)
\(n_{Fe}=1.25\cdot0.15=0.1875\left(mol\right)\)
\(2Fe+6H_2SO_{4\left(đ\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(0.1875..........................................0.28125\)
\(V_{SO_2}=6.3\left(l\right)\)
1 Hòa tan hết 20g hỗn hợp Fe và FeO cần dùng vừa đủ 300g dd H2SO4 loãng , thu được dd X và 2,24l khí thoát ra ở đktc.Tính % khối lượng của sắt trong hõn hợp trên
Tính C% của dd H2SO4 ban đầu và C%muối trong dd X
2 Cho 8,4 gam bột sắt vào 100ml dd CuSO4 1M(D=1,08g/ml) đến khi phản ứng kết thúc thu được chất rắn X và dd Y
Viết PTHH
Tính a và C% chất tan có trong dd Y
3Cho Ag hỗn hợp Fe,Cu có khối lượng bằng nhau vào dd H2SO4 loãng dư thu được 2,24 l khí (đktc), chất rắn ko tan đem hòa tan hết trong dd H2SO4 đậm đặc nóng thu được Vlít SO2 (đktc). Ngâm Ag hỗn hợp trên vào dd CuSO4 dư.
Tính V
Tính khối lượng chất rắn thu được sau phản ứng
1, hai miếng al và mg có thể tịch bằng nhau đem hòa tan hết trong dung dịch H2SO4 loãng dư, thấy thể tích khí thoát ra do al pư gấp đôi thể tích khí do mg pư. tìm khối lượng riêng của mg biết khối lượng riêng của Al là 2,7g/cm3
2,cho 7,2g hỗn hợp A gồm fe và oxit của fe hòa tan hết trong Hcl dư thu được 0,56l H2 đkc và ddB. cho B tác dung với dd naoh dư đun sôi trong không khí, lọc lấy kết tủa rửa sạch làm khô và nung ở nhiệt độ cao dến khối lượng ko đổi đc đúng 8g chất rắn.. timf ct oxit fe
GIÚP MÌNH NHA! MÌNH ĐANG RẤT GẤP! MƠN CÁC BẠN NHIỀU LẮM
Hòa tan m gam Fe trong dung dịch H 2 S O 4 loãng thì sinh ra 3,36 lít khí (đktc). Nếu cho m gam sắt này vào dung dịch H 2 S O 4 đặc, nóng thì thể tích khí (đktc) sinh ra bằng
A. 2,24 lít
B. 5,04 lít
C. 3,36 lít
D. 10,08 lít
GIÚP EM VỚI Ạ HUHU:((
chia m gam hỗn hợp X gồm Fe và FeO thành 2 phần bằng nhau
Phần 1: hòa tan hoàn toàn phần 1 trong h2so4 loãng dư thì thu đc 0,2 mol khí
Phần 2: hòa tan hết trong h2so4 đặc , dư thì thu được 0,35 mol khí So2 ( duy nhất )
a. tính giá trị m
b. tính số mol NaOH tối thiểu cần để hấp thụ hết lượng khí So2 trên
Cho 26,7 g hh A gồm Mg, Fe, Al tan hết trong dd H2SO4 lấy dư .sau phản ứng xong thu được 17,92 lít khí( ĐKTC). Biết thể tích khí thoát ra do Sắt hòa tan gấp 2 lần thể tích khí tạo ra khi Magie tan
a) Tính thành phần phần trăm khối lượng mỗi chất trong hh A
b) Tính khối lượng H2SO4
b) Tính khối lượng H2SO4 dư sau pư, biết H2SO4 đã lấy dư so với lượng pư là 10%
Hòa tan 2,8g Fe vào dd H2SO4 loãng vừa đủ pư. Sau khi pư xảu ra hoàn toàn thu được dd A khí B
a) Viết PTHH xác định chất tan có trong dd và xác định khí B
b) Tính khối lượng chất tan có trong dd A
c) Tính thể tích khí B sinh ra ở đktc
\(n_{Fe}=\dfrac{2.8}{56}=0.05\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
a) Chất tan : FeSO4
Chất khí : H2
\(m_{FeSO_4}=0.05\cdot152=7.6\left(g\right)\)
\(V_{H_2}=0.05\cdot22.4=1.12\left(l\right)\)
Fe + H2SO4 -> FeSO4 + H2
1 1 1 1
A là: FeSO4
B là: H2
nFe = 2,8/56 = 0,05 mol => nH2SO4 = 0,05 mol
mFeSO4 = 0,05 x (56+32+64) = 7,6 gam
VH2 = 0,05 x 22,4 = 1,12 lit