Cho các ion: N a + ; A l 3 + ; S O 4 2 - ; N O 3 - ; C a 2 + ; N H 4 + ; C l - . Hỏi có bao nhiêu cation ?
A. 2.
B. 3.
C. 4.
D. 5.
Câu 31: Cho các ion SO4 2-, S2-, OH-, NH4+, Al3+. Có bao nhiêu ion đa nguyên tử?
A. 1
B. 2
C. 3
D. 4
Câu 32: Cho các ion SO4 2-, S2-, OH-, NH4+, Al3+. Có tổng cộng bao nhiêu cation?
A. 2
B. 3
C. 4
D. 5
Câu 33: Nguyên tử X có tổng số hạt là 58, trong đó số hạt mang điện gấp 1,9 lần số hạt không
mang điện. Số hạt proton của nguyên tử X là?
A. 19
B. 20
C. 11
D. 12
Câu 34: Một nguyên tử R có tổng số hạt là 34, trong đó số hạt mang điện nhiều gấp 1,8333
lần số hạt không mang điện. Số khối của nguyên tử R là?
A. 19
B. 23
C. 11
D. 12
Câu 35: Một thanh sắt chứa 0,2 mol Fe trong đó có 55Fe (5,84%), 56Fe (91,68%), 57Fe (2,17%)
và 58Fe. Hỏi thanh sắt nặng bao nhiêu gam?
A. 17,21
B. 21,71
C. 19,11
D. 11,19
Câu 36: Brom có 2 đồng vị
79Br và 81Br. Biết khối lượng nguyên tử trung bình của Brom là
79,91. % số nguyên tử của đồng vị
81Br và 79Br lần lượt là?
A. 54,5% và 45,5%
B. 45,5% và 54,5%
C. 70% và 30%
D. 30% và 70%
Dung dịch A có các ion: ![]()
Dung dịch B có các ion: ![]()
Dung dịch C có các ion: ![]()
Có thể xảy ra phản ứng nào khi trộn lẫn các dung dịch A + B; B + C; A + C.Viết các PTHH của các phản ứng xảy ra dưới dạng ion.
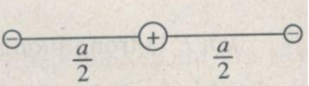
Một hệ điện tích có cấu tạo gồm một ion dương +e và hai ion âm giống nhau nằm cân bằng. Khoảng cách giữa hai ion âm là α. Bỏ qua trọng lượng của các ion. Hãy cho biết cấu trúc của hệ và khoảng cách giữa ion dương và ion âm (theo a).
Trong trạng thái cân bằng, những lực điện tác dụng lên mỗi ion cân bằng lẫn nhau. Điều đó có nghĩa là tất cả các lực phải có cùng một giá hay ba ion phải nằm trên cùng một đường thẳng. Mặt khác, hai ion âm phải nằm đối xứng với nhau ở hai bên ion dương (Hình 1.2 G), thì lực điện do chúng tác dụng lên ion dương mới có thể cân bằng nhau.
Cho các ion sau :
a P O 4 2 - b C O 3 2 - c H S O 3 - d H C O 3 - ( d ) H P O 3 2 -
Theo Bron-stêt những ion nào là lưỡng tính ?
A. (a), (b).
B. (b), (c).
C. (c), (d).
D. (d), (e).
Trong một từ trường đều có vectơ B thẳng đứng, cho một dòng các ion bắt đầu đi vào từ điểm A và đi ra tại C sao cho AC là 1/2 đường tròn trong mặt phẳng ngang. Các ion có cùng điện tích, cùng vận tốc đầu. Cho biết khoảng cách AC đối với ion C2 H5 O+ là 22,5cm. Xác định khoảng cách AC đối với các ion C2 H5 OH+,C2 H5 +,OH+,CH2 OH+,CH3+,CH2+.
Trong từ trường đều B, ion C2H5O+ (m1 = 45đvC) chuyển động tròn với bán kính R1.
Ta có: 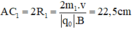
- Đối với ion C2H5OH (m2 = 46đvC)
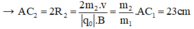
- Đối với ion C2H5+ (m3 = 29đvC)
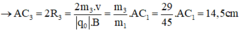
- Đối với ion OH+ (m4 = 17đvC)
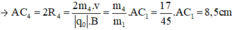
- Đối với ion CH2OH+ (m5 = 31đvC)
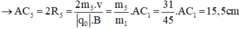
- Đối với ion CH3+ (m6 = 15đvC)
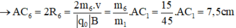
- Đối với ion CH2+ (m7 = 14đvC)
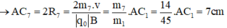
Cho các ion sau: O 2 - , M g 2 + , F e 2 + , Z n 2 + , S e 2 - , B r ¯ . Ion có đặc điểm khác với các ion còn lại là
A. M g 2 +
B. F e 2 +
C. Z n 2 +
D. B r ¯
B
Ion F e 2 + có cấu hình electron 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 6 , có phân lớp electron ngoài cùng chưa bão hòa. Tất cả cá ion còn lại đều có các phân lớp electron đã bão hòa
Viết quá trình cho hoặc nhận electron của các nguyên tử sau: Na, Mg, K, Ca, Al, F, Cl, O, N, S.
- Hãy mô tả sự hình thành liên kết ion từ các nguyên tử tương ứng trong các hợp chất sau: NaF,
Na2O, MgO, MgF2.
- Các hợp chất ion có các đặc điểm gì?
1/ Quá trình nhường - nhận electron.
\(Na^0\rightarrow Na^++e\)
\(Mg^0\rightarrow Mg^{2+}+2e\)
\(Ca^0\rightarrow Ca^{2+}+2e\)
\(F^0+e\rightarrow F^-\)
\(Cl^0+e\rightarrow Cl^-\)
\(O^0+2e\rightarrow O^{2-}\)
\(N^0+3e\rightarrow N^{3-}\)
\(S^0+2e\rightarrow S^{2-}\)
2/ Sự hình thành liên kết ion.
- Trong NaF:
+ Nguyên tử Na nhường 1e.
+ Nguyên tử F nhận 1e.
+ Nguyên tử Na và F tích điện trái dấu nên chúng hút nhau tạo thành phân tử NaF.
- Na2O, MgO, MgF2 giải thích tương tự.
3/ Đặc điểm của các hợp chất ion:
- Các hợp chất ion hầu hết là thể rắn ở nhiệt độ thường, khó tan chảy, khó bay hơi. Chẳng hạn, nhiệt độ nóng chảy của NaCl là 801 oC, nhiệt độ sôi của NaCl là 1465 oC.
- Khi các hợp chất này nóng chảy, hoặc hoà tan trong nước, lực hút tĩnh điện giữa các ion này yếu đi, kết quả là chúng phân li ra các ion trần, nên chúng dẫn điện tốt.
- Ở trạng thái rắn, các hợp chất ion không dẫn được điện.
Màu đỏ của rubi do ion nào phát ra ?
A. Ion nhôm. B. Ion ôxi.
C. Ion crôm. D. Các ion khác.
Cho các ion: Li+, Ca2+, Al3+, F-, O2-, PO43-. Hãy viết công thức tất cả các hợp chất ion (tạo nên từ một loại cation và một loại anion) có thể được tạo thành từ các ion đã cho. Biết rằng tổng điện tích của các ion trong hợp chất bằng 0.
- \(Li_x^ + F_y^ - \): (+1).x + (-1).y = 0
=> x = y = 1
=> Công thức: LiF
- \(Li_x^ + O_y^{2 - }\): (+1).x + (-2).y = 0
=> x = 2, y = 1
=> Công thức: Li2O
- \(Li_x^ + (P{O_4})_y^{3 - }\): (+1).x + (-3).y = 0
=> x = 3, y = 1
=> Công thức: Li3PO4
- \(Ca_x^{2 + }F_y^ - \): (+2).x + (-1).y = 0
=> x =1, y = 2
=> Công thức: CaF2
- \(Ca_x^{2 + }O_y^{2 - }\): (+2).x + (-2).y = 0
=> x = y = 1
=> Công thức: CaO
- \(Ca_x^{2 + }(P{O_4})_y^{3 - }\): (+2).x + (-3).y = 0
=> x = 3, y = 2
=> Công thức: Ca3(PO4)2
- \(Al_x^{3 + }F_y^ - \): (+3).x + (-1).y = 0
=> x = 1, y = 3
=> Công thức: AlF3
- \(Al_x^{3 + }O_y^{2 - }\): (+3).x + (-2).y = 0
=> x = 2, y = 3
=> Công thức: Al2O3
- \(Al_x^{3 + }(P{O_4})_y^{3 - }\): (+3).x + (-3).y = 0
=> x = y = 1
=> Công thức: AlPO4
dd A chứa các ion Al3+, Mg2+, Cl- để làm kết tủa hết ion Cl- trong 100ml dd A. Dùng 200ml dd AgNO3 0,3M. mặt khác cho 400ml dd NaOH 0.3 M vào 100ml dd A thu được 0.87g kết tủa. Tính nồng đồ mol các ion trong dd A