Dung dịch axit loãng H 2 S O 4 khi phản ứng với chất nào dưới đây mà khí H 2 không giải phóng ra (không được sinh ra)?
A. Fe
B. Cu
C. Mg
D. Al
Câu 1:Để hòa tan hoàn toàn 1,2g một kim loại hóa trị (II) phải dùng 250ml dung dịch H2SO4 loãng chưa rõ nồng độ, thu được 1,12 lit khí (đktc) sau phản ứng
a.Tìm kim loại hóa trị II trên
b.Tính mồng độ mol/l của dd axit H2SO4 đã phản ứng
Câu 2 : Nung 11.2g Fe với 3,2g bột S ở nhiệt độ cao
a.Sau khi phản ứng hoàn toàn thu đc những chất nào? Khối lượng bao nhiêu?
b.Cho hỗn hợp thu được tác dụng với axit H2SO4 loãng. Viết ptpư xảy ra và tính thể tích khí thoát ra ngoài ở đktc
Ai làm đc thì giúp mình với
chất nào trong các chất sau phản ứng với dung dịch axit loãng tạo ra muối và khí H2 A: MgO B: Mg(OH)2 C: Mg D: MgCl2
Chọn C: Mg
kl pứ với axit tạo khí H2 (kl đứng trước H)
Cho 22,4g sắt tác dụng với dung dịch axit sunfuric loãng có chứa 24,5g H₂SO₄ a. Chất nào còn dư sau phản ứng và dư bao nhiêu gam? b. Tính thể tích khí hiđro thu được ở đktc
a) nFe=0,4(mol); nH2SO4=0,5(mol)
PTHH: Fe + H2SO4 -> FeSO4 + H2
Ta có: 0,4/1 < 0,5/1
=> Fe hết, H2SO4 dư. tính theo nFe.
=> nH2= nH2SO4(p.ứ)=nFe=0,4(mol)
=>nH2SO4(dư)=0,5-0,4=0,1(mol)
=>H2SO4(dư)=0,1.98=9,8(g)
b) V(H2,dktc)=0,4.22,4=8,96(l)
Cho hình vẽ mô tả thí nghiệm điều chế khí X khi cho dung dịch axit tác dụng với chất rắn (kim loại hoặc muối). Hình vẽ dưới minh họa phản ứng nào sau đây?
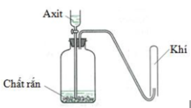
A. CaCO3 + 2HCl → CaCl2 + CO2 + H2O
B. Zn + 2HCl → ZnCl2 + H2
C. 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
D. Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Cho hình vẽ mô tả thí nghiệm điều chế khí X khi cho dung dịch axit tác dụng với chất rắn (kim loại hoặc muối). Hình vẽ dưới minh họa phản ứng nào sau đây?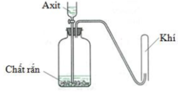
A. CaCO3 + 2HCl → CaCl2 + CO2 + H2O
B. Zn + 2HCl → ZnCl2 + H2
C. 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
D. Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Cho hình vẽ mô tả thí nghiệm điều chế khí X khi cho dung dịch axit tác dụng với chất rắn (kim loại hoặc muối). Hình vẽ dưới minh họa phản ứng nào sau đây?
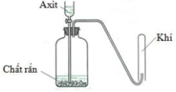
A. CaCO3 + 2HCl → CaCl2 + CO2 + H2O
B. Zn + 2HCl → ZnCl2 + H2
C. 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
D. Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Cho hình vẽ mô tả thí nghiệm điều chế khí X khi cho dung dịch axit tác dụng với chất rắn (kim loại hoặc muối). Hình vẽ dưới minh họa phản ứng nào sau đây?

A. C u + 4 H N O 3 → C u N O 3 2 + 2 N O 2 + 2 H 2 O
B. C a C O 3 + 2 H C l → C a C l 2 + C O 2 + H 2 O
C. F e + 2 H C l → F e C l 2 + H 2
D. 2 K M n O 4 + 16 H C l → 2 K C l + 2 M n C l 2 + 5 C l 2 + 8 H 2 O
Đáp án C
Khí X thu được bằng cách úp ngược ống nghiệm => khí X nhẹ hơn không khí
1. loại NO2 nặng hơn không khí
2. loại CO2 nặng hơn không khí
3. Thỏa mãn vì H2 nhẹ hơn không khí
4. loại vì Cl2 nhẹ nặng hơn không khí
Câu 3: Cho 5,6 gam Fe tác dụng vừa đủ với dung dịch HCl (loãng).
a. Tính thể tích khí H, thu được sau phản ứng (ở đktc).
b. Tính khối lượng dung dịch axit HCl (loãng) phản ứng và muối FeCl, thu được sau phản ứng.
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\\ PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{H_2}=n_{FeCl_2}=n_{Fe}=0,1\left(mol\right);n_{HCl}=2.0,1=0,2\left(mol\right)\\ a,V_{H_2\left(đktc\right)}=0,1.22,4=2,24\left(l\right)\\ b,m_{HCl}=0,2.36,5=7,3\left(g\right)\\ m_{FeCl_2}=127.0,1=12,7\left(g\right)\)
Cái khí ở dạng phân tử nên là H2 chứ không phải H em nha!
Thực hiện các thí nghiệm sau:
(1) Cho Zn phản ứng với dung dịch HNO3 loãng không tạo khí;
(2) Cho lượng nhỏ Na vào dung dịch CuSO4 dư;
(3) Sục khí NO2 vào dung dịch NaOH dư;
(4) Cho Fe3O4 vào dung dịch H2SO4 loãng dư;
(5) Sục khí NH3 vào dung dịch Mg(NO3)2 dư.
Số thí nghiệm mà dung dịch thu được có chứa 2 muối sau khi kết thúc phản ứng là
A. 3.
B. 4.
C. 5.
D. 2.
Chọn đáp án C
Cả 5 thí nghiệm đều thu được 2 muối
(1) Không tạo khí ⇒ 2 muối là Zn(NO3)2 và NH4NO3
(2) CuSO4 dư ⇒ Sau khi 1 phần Cu2+ bị kết tủa, dung dịch còn lại Na2SO4 và CuSO4
(3) Phản ứng tự oxi hóa khử: 2NaOH + 2NO2 → NaNO3 + NaNO2 + H2O
(4) H2SO4 loãng ⇒ Tạo 2 muối là FeSO4 và Fe2(SO4)3
(5) Mg(NO3)2 dư
⇒ Sau khi 1 phần Mg2+ bị kết tủa, dung dịch còn lại NH4NO3 và Mg(NO3)2.