Một loại quặng chứa 82% Fe 2 O 3 . Thành phần phần trăm của Fe trong quặng theo khối lượng là:
A. 57,4%
B. 57,0 %
C. 54,7%
D. 56,4 %
một loại quặng chứa 82% Fe2O3. Thành phần phần trăm của Fe trong quặng theo khối lượng là bao nhiêu?
A là một quặng sắt chứa 50% Fe2O3, B là một loại quặng sắt khác chứa 60% Fe3O4 trộn quặng A với quặng B theo tỉ lệ về khối lượng là mA/mB= 4/2 ta được quặng C. Tìm khối lượng của Fe trong quặng C.
1. A là 1 loại quặng chứa 60% Fe2O3; B là 1 loại quặng khác chứa 69,6% Fe3O4. Hỏi trog 1 tấn quặng nào chứa nhiều sắt hơn? Là bn kg?
2. Trộn quặng A vs quặng B theo tỉ lệ khối lượng là mA: mB= 2:5 ta dc quặng C. Hỏi trog 1 tấn quặng C có bn kg sắt?
Câu 1 :
mFe2O3 ( A ) = 0.6 tấn
mFe = (0.6/160)*112= 0.42 tấn
mFe3O4 ( B) = 0.696 tấn
mFe ( 0.696/232)*168= 0.504 tấn
=> Quặng B chứa nhiều sắt hơn
m = 0.504 - 0.42 = 0.084 tấn
Câu 2 :
Chọn tỉ lệ là : 2, 5
Trộn 2 tấn quặng A với 5 tấn quặng B thu được 7 tấn quặng C :
mFe ( C) = 2*0.42 + 5*0.504=3.36 tấn
Vậy trong 1 tấn quặng C có : 3.36/7 = 0.48 tấn
tính thành phần phần trăm theo khối lượng của mổi nguyên tố lần lượt trong :
a, KMnO4 KClO3, Al2O3, Na2CO3,Fe2(SO4)3
b,quặng sắt chứa 80‰Fe3O4, quặng nhôm chứa 60 ‰Al2O3
a)+) \(M_{KMnO_4}\)\(=39+55+16.4=158\) (g/mol)
Trong 1 mol KMnO4 có 1 mol K ứng với khối lượng 39 (g/mol), 1 mol Mn ứng với k.lượng 55 (g/mol), 4 mol O ứng với k.lượng 64 (g/mol)
- %\(m_K\)=\(\dfrac{39}{158}.100\)%\(\approx\)24,68%
%\(m_{Mn}\)=\(\dfrac{55}{158}.100\)%\(\approx\)34,81%
%\(m_O\)=100%-(24,68+34,81)%=40,51%
+) \(M_{KClO_3}\)=39+35,5+16.3=122,5(g/mol)
trong 1 mol hợp chất có 1 mol K ứng với k.lượng 39 (g/mol), 1 mol Cl ứng với k.lượng 35,5 (g/mol), 3 mol O ứng với k.lượng 48(g/mol)
- %\(m_K=\dfrac{39}{122,5}.100\)%\(\approx\)31,84%
%\(m_{Cl}=\dfrac{35,5}{122,5}.100\)%\(\approx\)28,98%
%\(m_O\)=100%-(31,84+28,98)%=39,18%
+) \(M_{Al_{2}O_{3}}=27.2+16.3=102(g/mol)\)
trong 1 mol hợp chất có 2 mol Al ứng với k.lượng 54 (g/mol), 3 mol O ứng với k.lượng 48 (g/mol)
- %\(m_{Al}=\dfrac{54}{102}.100\)%\(\approx\)52,94%
%\(m_O=\) 100%-52,94%=47,06%
+) \(M_{Na_{2}CO_{3}}\)= 23.2+12+16.3=106 (g/mol)
trong 1 mol h.chất có 2 mol Na ứng với k.lượng 46 (g/mol), 1 mol C ứng với k.lượng 12 (g/mol), 3 mol O ứng với k.lượng 48 (g/mol)
- %\(m_{Na}=\dfrac{46}{106}.100\)%\(\approx\)43,4%
%\(m_C=\dfrac{12}{106}.100\)%\(\approx\)11,32%
%\(m_O=\)100%-(43,4+11,32)%=45,28%
+) \(M_{Fe_{2}(SO_{4})_{3}}\)\(=56.2+(32+16.4).3=400(g/mol)\)
trong 1 mol h.chất có 2 mol Fe ứng với k.lượng 112 (g/mol), 3 mol S ứng với k.lượng 96 (g/mol), 12 mol O ứng với k.lượng 192(g/mol)
%\(m_{Fe}=\dfrac{112}{400}.100\)%=28%
%\(m_S=\dfrac{96}{400}.100\)%=24%
%\(m_O=\)100%-(28+24)%=48%
b) không hiểu ý của đề "quặng sắt chứa 80‰Fe3O4, quặng nhôm chứa 60‰Al2O3" là gì cả?
a) Nếu hàm lượng % của kim loại A trong A22(CO3)x là 40% thì hàm lượng % của A trong hợp chất A3(PO4)x là bao nhiêu?
b) Quặng A chứa 60% Fe2O3, quặng B chứa 69,6% Fe2O4. Nếu trộn quặng A và quặng B theo tỉ lệ khối lượng là mA : mB = 2:5 để được quặng C thì trong 1 tấn quặng C có bao nhiêu kg Fe?
a)
M = 2A + 60x (g)
M = 3A + 95x (g)
\(\%A\left(CO3\right)=\frac{2A}{2A+60x}\cdot100\%=40\%\)
\(\Leftrightarrow2A+60x=5A\)
\(\Leftrightarrow3A=60x\)
\(\Leftrightarrow A=20x\)
\(\%A3\left(PO4\right)x=\frac{3A}{3A+95x}\cdot100\%\)
\(\Leftrightarrow\frac{3A}{3A+95\cdot\frac{A}{20}}\cdot100\%\)
\(\Leftrightarrow\frac{3A}{7.75A}\cdot100\%=38.71\%\)
b) Gọi: x là kl quặng A , y là kl quặng B
<=> x + y = 1
2x - 5y = 0
=> x = 5/7
y = 2/7
mFe ( A) = 0.6*5/7*2/160=3/560 ( tấn )
mFe ( B) = 0.696*2/7*3/232= 9/3500 (tấn )
mFe = 8 kg
Một loại quặng sắt manhetit chứa 90% Fe3O4. Tính khối lượng của Fe có trong 1 tấn quặng trên.
Khối lường Fe3O4 có trong 1 tấn quặng là :
mFe3O4 = 1 x 90% = 0,9 ( tấn )
Khối lượng Fe trong Fe3O4 chiếm :
% Fe = 3 x 56 / ( 3x 56 + 4 x 16 ) = 72,41 %
Khối lượng Fe có trong 1 tấn quặng là :
mFe = 0,9 x 72,41%= 0,6517 ( tấn )
Khối lượng Fe3O4 trong 1 tấn quặng manhetit:
1: 100x90=0,9 (tấn)= 900 kg
\(\%m_{Fe}=\frac{3.M_{Fe}.100\%}{M_{Fe_3O_4}}=\frac{3.56.100}{232}\approx72,414\%\)
Khối lượng Fe:
900. 72,414%=651,726(kg)
Mọi người giúp mình với ạ ![]()
1) 60,1g Ba3(PO4)2 có chứa bao nhiêu nguyên tử O2?
2) Một muối sunfat của kim loại hóa trị (3) có chứa 15,79 % về khối lượng của kim loại trên.
a) Xác định kim loại hóa trị (3) và công thức háo học của muối sunfat?
b) Tính số nguyên tử O2 có trong lượng muối sunfat trên ?
3) a/ A là 1 quặng sắt chứa 60% Fe2O3 về khối lượng, B là 1 loại quặng sắt khác chứa 69,6% Fe3O4. Hỏi trong 1 tấn quặng A, 1 tấn quặng B chứa bao nhiêu kg Fe mỗi loại?
b/ Trộn quặng A vs quặng B theo tỉ lệ khối lượng \(\dfrac{m_A}{m_B}\) = \(\dfrac{2}{5}\) ta được quặng C. Hỏi trong mỗi tấn quặng C có bao nhiêu kg Fe trong tấn quặng C.
Làm ơn chỉ giùm mình, mình đang cần gấp.
1. nBa3(PO4)2 = 60,1/601 = 0,1 mol
(bạn xem lại đề mình nghĩ là nguyên tử O, không phải lả O2 vì O2 là phân tử )
trong Ba3(PO4)2 có 2.4= 8 nguyên tử O ⇒ nO = 8nBa3(PO4)2 = 0,8
vậy số nguyên tủ O là 0,8.(6,02.1023) = 4,816.1023
2. Gọi kim loại cần tìm là M
công thức chung của muối : M2(SO4)3
% về khối lượng = % về khối lượng mol
vì kim loại M chứa 15.79% về khối lượng nên gốc SO4 chiếm
100- 15,79 = 84,21% về khối lượng ta có
\(\dfrac{mM}{mSO4^{2-}}\) = \(\dfrac{M_M}{M_{SO4^{2-}}}\)= \(\dfrac{M_M.2}{96.3}\)= \(\dfrac{15,79}{84,21}\)⇒ MM= 27 (Al)
muối là Al2(SO4)3
Số nguyên tử O = 12 lần số phân tử Al2(SO4)3 vì trong Al2(SO4)3 CÓ 3.4=12 nguyên tử O
3. 1 tấn = 1000kg
trong 1 tấn quặng A chứa 1000.60% = 600kg Fe2O3
⇒nFe2o3 = 600/160 = 3,75 mol (mimhf không đổi ra gam nên cứ coi như Fe2O3 có số mol là 3,75 luôn vì đằng nào cũng tính khối lượng Fe theo kg )
trong 1 phân tử Fe2O3 chứa 2 nguyên tử Fe nên nFe = 2 nFe2O3
= 3,75.2 = 7,5 mol ⇒mFe = 7,5.56 = 420kg
hoặc bạn có thể tính mFe theo cách sau
\(\dfrac{mFe}{mFe2O3}\)= \(\dfrac{56.2}{160}\) ⇒ \(\dfrac{mFe}{600}\)=\(\dfrac{56.2}{160}\)⇒mFe = 420kg
tương tự bạn tính mFe trong hỗn hợp B
\(\dfrac{m_A}{m_B}\)= \(\dfrac{2}{5}\), mặt khác mA + mB = 1000
⇒ mA = (1000/7).2 = 2000/7 kg
mB = (1000/7).5 = 5000/7 kg
mFe trong C = mFe( trong A) + mFe(trong B)
bạn tính theo cách trên là ra
Một loại quặng sắt chứa 80% Fe2O3 và 10% SiO2. Hàm lượng các nguyên tử Fe và Si trong quặng này là :
A. 56% Fe và 4,7% Si
B. 54% Fe và 3,7% Si
C. 53% Fe và 2,7% Si
D. 52% Fe và 4,7% Si
Giả sử có 100 gam quặng sắt, khối lượng Fe2O3 là 80 gam và khối lượng SiO2 là 10 gam
Số mol Fe2O3 là nFe2O3 = 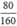 = 0,5(mol)
= 0,5(mol)
nFe = 2 x nFe2O3 = 0,5.2 = 1(mol)
→ mFe = 1.56 = 56(g)
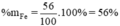
Tương tự tính cho Si , %Si = 4,7%
Đáp án là A.
Khử một lượng quặng hemantit chứa 82% (Fe,O,) thu được 2,52 tấn sắt, khối lượng quặng cần lấy là bao nhiêu? Biết H = 80% A. 5,487 tán B. 5,488 tấn C. 5,489 tấn D. 5,486 tấn
Quặng hemantit chứa thành phần chính là : Fe2O3
Bảo toàn nguyên tố Fe: \(n_{Fe_2O_3}.2=n_{Fe}\\ \Rightarrow n_{Fe_2O_3}=0,0225\left(mol\right)\\ VìH=80\%\Rightarrow m_{Fe_2O_3}=\dfrac{0,0225}{80\%}.160=4,5\left(tấn\right)\\ m_{quặng}=\dfrac{4,5}{82\%}=5,488\left(tấn\right)\)