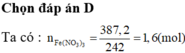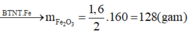Một loại quặng A chứa 90% fe3o4, còn lại là tạp chất không tham gia phản ứng. Cho khí hidro qua m gam quặng A nung nóng thu được chất rắn B có khối lượng bằng 80% khối lượng quặng ban ban đầu. Tính hiệu suất phản ứng

Những câu hỏi liên quan
Một loại quặng A chứa 90% fe3o4, còn lại là tạp chất không tham gia phản ứng. Cho khí hidro qua m gam quặng A nung nóng thu được chất rắn B có khối lượng bằng 80% khối lượng quặng ban ban đầu. Tính hiệu suất phản ứngGIÚP MIK VỚI MN ƠI, MIK SẮP THI HU...
Xem chi tiết
Coi :
\(m_A = 232(gam)\\ \Rightarrow n_{Fe_3O_4} = 232.90\% : 232 = 0,9(mol)\\ \text{Gọi hiệu suất phản ứng là a}\Rightarrow n_{Fe_3O_4\ pư} = 0,9a(mol)\\ Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O\\ n_{Fe} = 0,9a.3 = 2,7a(mol)\\ n_{Fe_3O_4\ dư} = 0,9 - 0,9a(mol)\\ m_B = 2,7a.56 + (0,9 - 0,9a).232 = 232.80\%\\ \Rightarrow a = 0,4028 = 40,28\%\)
Đúng 1
Bình luận (0)
Một loại quặng A chứa 90% fe3o4, còn lại là tạp chất không tham gia phản ứng. Cho khí hidro qua m gam quặng A nung nóng thu được chất rắn B có khối lượng bằng 80% khối lượng quặng ban ban đầu. Tính hiệu suất phản ứng
Nung m gam một loại quặng canxit chứa a% về khối lượng tạp chất trơ, sau một thời gian thu được 0,78m gam chất rắn, hiệu suất của phản ứng nhiệt phân là 80%. Giá trị của a là A. 37,5. B. 67,5. C. 62,5. D. 32,5.
Đọc tiếp
Nung m gam một loại quặng canxit chứa a% về khối lượng tạp chất trơ, sau một thời gian thu được 0,78m gam chất rắn, hiệu suất của phản ứng nhiệt phân là 80%. Giá trị của a là
A. 37,5.
B. 67,5.
C. 62,5.
D. 32,5.
Cho một luồng khí H2 (lấy dư) qua ống sứ đựng 10 gam quặng hemantit được đốt nóng ở nhiệt độ cao, sau khi phản ứng kết thúc, lấy chất rắn còn lại trong ống sứ đem hòa tan trong dung dịch HCl (lấy dư) thì thu được 2,24 lít khí H2 (đktc). Cho rằng quặng hemantit chứa Fe2O3 và các tạp chất coi như trơ. a) Tính phần trăm khối lượng Fe2O3 có trong quặng b) Cần bao nhiêu tấn quặng hemantit nói trên để sản xuất được 1 tấn gang chứa 96% sắt? Biết hiệu suất của quá trình là 80%.
Đọc tiếp
Cho một luồng khí H2 (lấy dư) qua ống sứ đựng 10 gam quặng hemantit được đốt nóng ở nhiệt độ cao, sau khi phản ứng kết thúc, lấy chất rắn còn lại trong ống sứ đem hòa tan trong dung dịch HCl (lấy dư) thì thu được 2,24 lít khí H2 (đktc). Cho rằng quặng hemantit chứa Fe2O3 và các tạp chất coi như trơ.
a) Tính phần trăm khối lượng Fe2O3 có trong quặng
b) Cần bao nhiêu tấn quặng hemantit nói trên để sản xuất được 1 tấn gang chứa 96% sắt? Biết hiệu suất của quá trình là 80%.
a. nH2 = nFe = 0,1mol
Bảo toàn nguyên tố Fe => nFe2O3 = 0,05mol
=> mFe2O3 = 8g
=> %Fe2O3 = (8:10) . 100% = 80%
Đúng 0
Bình luận (0)
Nung một loại đá vôi có chứa 80% CaCO3, phần còn lại là tạp chất trơ.Biết lượng đá vôi là 500g. Chất rắn còn lại sau hi nung có khối lượng=78% khối lượng đá vôi ban đầu.Tính hiệu suất phản ứng(biết chất trơ không tham gia phản ứng phân huỷ) đề lớp 8 mn giúp m vs
mCaCO3= 80%. m(đá vôi)= 80%. 500=400(g)
-> nCaCO3= mCaCO3/M(CaCO3)=400/100=4(mol)
PTHH: CaCO3 -to-> CaO + CO2
Ta có: nCaO(LT)= nCaCO3= 4(mol)
=> mCaO(LT)=56.4=224(g)
Đặt x là số mol CaCO3 (p.ứ) -> Số mol CaO tạo thành là x (mol) (x>0)
=> Khối lượng rắn tạo thành là:
(400 - 100x) + 56x + 100= 78%. 500
<=>x=2,5(mol)
Vì KL tỉ lệ thuận số mol:
=> H(p.ứ)= (2,5/4).100= 62,5%
Đúng 2
Bình luận (2)
Một loại quặng sắt chứa 90% Fe3O4 còn lại là tạp chất ko chứa sắt tính khối lượng quặng còn lại để thu được 25,2(g) sắt
helpppp me ạ
Nung m gam một loại quặng canxit chứa a% về khối lượng tạp chất trơ, sau một thời gian thu được 0,78m gam chất rắn, hiệu suất của phản ứng nhiệt phân là 80%. Giá trị của a là
Xem chi tiết
CaCO3 \(\rightarrow\) CaO + CO2
BTKL : mCO2 = m - 0,78m = 0,22 m
Từ pt: \(\frac{mCaCO3}{mCO2}\) = \(\frac{100}{44}\) \(\rightarrow\) mCaCO3pứ = 0,5m
H= 80%
\(\rightarrow\) mCaCO3thựctế =\(\frac{0,5}{80}\).100 = 0,625m
\(\rightarrow\)a =\(\frac{0,625}{1}\) .100 = 62.5%
Đem nung nóng một lượng quặng hematit (chứa Fe2O3, có lẫn tạp chất trơ) cho vào luồng khí CO đi qua, thu được 300,8 gam hỗn hợp các chất rắn, đồng thời có hỗn hợp khí thoát ra. Cho hấp thụ hỗn hợp khí này vào bình đựng lượng dư dung dịch xút thì thấy khối lượng bình tăng thêm 52,8 gam. Nếu hòa tan hết hỗn hợp chất rắn trong lượng dư dung dịch HNO3 loãng thì thu được 387,2 gam một muối nitrat. Hàm lượng Fe2O3 (% khối lượng) trong loại quặng hematit này là: A. 80% B. 20% C. 60% D. 40%
Đọc tiếp
Đem nung nóng một lượng quặng hematit (chứa Fe2O3, có lẫn tạp chất trơ) cho vào luồng khí CO đi qua, thu được 300,8 gam hỗn hợp các chất rắn, đồng thời có hỗn hợp khí thoát ra. Cho hấp thụ hỗn hợp khí này vào bình đựng lượng dư dung dịch xút thì thấy khối lượng bình tăng thêm 52,8 gam. Nếu hòa tan hết hỗn hợp chất rắn trong lượng dư dung dịch HNO3 loãng thì thu được 387,2 gam một muối nitrat. Hàm lượng Fe2O3 (% khối lượng) trong loại quặng hematit này là:
A. 80%
B. 20%
C. 60%
D. 40%
Đem nung nóng một lượng quặng hemantit (chứa Fe2O3, có lẫn tạp chất trơ) và cho luồng khí CO đi qua, thu được 300,8 gam hỗn hợp các chất rắn, đồng thời có hỗn hợp khí thoát ra. Cho hấp thụ hỗn hợp khí này vào bình đựng lượng dư dung dịch xút thì thấy khối lượng bình tăng thêm 52,8 gam. Nếu hòa tan hết hỗn hợp chất rắn trong lượng dư dung dịch HNO3 loãng thì thu được 387,2 gam một muối nitrat. Hàm lượng Fe2O3 (% khối lượng) trong loại quặng hematite này là A. 80% B. 20% C. 40% ...
Đọc tiếp
Đem nung nóng một lượng quặng hemantit (chứa Fe2O3, có lẫn tạp chất trơ) và cho luồng khí CO đi qua, thu được 300,8 gam hỗn hợp các chất rắn, đồng thời có hỗn hợp khí thoát ra. Cho hấp thụ hỗn hợp khí này vào bình đựng lượng dư dung dịch xút thì thấy khối lượng bình tăng thêm 52,8 gam. Nếu hòa tan hết hỗn hợp chất rắn trong lượng dư dung dịch HNO3 loãng thì thu được 387,2 gam một muối nitrat. Hàm lượng Fe2O3 (% khối lượng) trong loại quặng hematite này là
A. 80%
B. 20%
C. 40%
D. 60%
Đáp án : C
mbình tăng = mCO2 = 52,8g => nCO2 = 1,2 mol = nO pứ
=> mquặng = mchất rắn + mO pứ = 320g
Chất rắn + HNO3 -> muối Fe(NO3)3 => nFe2O3 = ½ nFe(NO3)3 = 0,8 mol
=> %mFe2O3(quặng) = 40%
Đúng 0
Bình luận (0)