cho 28 gam sắt tác dụng vs dung dịch loãng có chứa 58,8 gam axit sunfuric tạo thành sắt sunfat
a. tính khối lượng chất dư sau phản ứng
b. tính thể tích hiđro thu được ở đktc
c. dẫn khí thu được qua đồng (II) oxit, tính khối lượng đồng tạo thành
giúp mình với









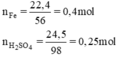

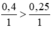 ⇒ Fe dư
⇒ Fe dư













