5) Nhúng một thanh kim loại Fe vào 200 ml dung dịch AgNO3 2,5M. Sau một thời gian khối lượng thanh kim loại tăng 16 g. Tính nồng độ dung dịch thu được sau phản ứng. Giả sử kim loại thoát ra bám vào thanh sắt.

Những câu hỏi liên quan
Nhúng thanh Fe nặng 100g vào 100 ml dung dịch Cu(NO3)2 2M. Sau một thời gian lấy thanh Fe ra rửa sạch làm khô cân được 101,2g (giả sử kim loại thoát ra bám hết lên thanh Fe). Khối lượng Fe đã phản ứng là : A. 11,20 B. 7,47 C. 8,40 D. 0,84
Đọc tiếp
Nhúng thanh Fe nặng 100g vào 100 ml dung dịch Cu(NO3)2 2M. Sau một thời gian lấy thanh Fe ra rửa sạch làm khô cân được 101,2g (giả sử kim loại thoát ra bám hết lên thanh Fe). Khối lượng Fe đã phản ứng là :
A. 11,20
B. 7,47
C. 8,40
D. 0,84
Giải thích: Đáp án C
nCu2+ = nCu(NO3)2 = 0,2 mol
Fe + Cu2+ -> Fe2+ + Cu
1 mol Fe phản ứng tạo 1 mol Cu => mtăng = 64 – 56 = 8g
=> nFe pứ = (101,2 – 100)/8 = 0,15 mol
=> mFe pứ = 8,4g
Đúng 0
Bình luận (0)
Cho 12,8g kim loại A phản ứng hoàn toàn với khí clo thu được muối B. Hòa tan B vào nước thu được 400ml dung dịch C. Nhúng thanh Fe nặng 11,2g vào dung dịch C, sau một thời gian thấy kim loại A bám vào thanh Fe và khối lượng thanh sắt lúc này là 12g, nồng độ FeCl2 0,25M. Tính nồng độ mol của muối B trong dung dịch C A. 1M B. 0,75M C. 0,25M D. 0,5M
Đọc tiếp
Cho 12,8g kim loại A phản ứng hoàn toàn với khí clo thu được muối B. Hòa tan B vào nước thu được 400ml dung dịch C. Nhúng thanh Fe nặng 11,2g vào dung dịch C, sau một thời gian thấy kim loại A bám vào thanh Fe và khối lượng thanh sắt lúc này là 12g, nồng độ FeCl2 0,25M. Tính nồng độ mol của muối B trong dung dịch C
A. 1M
B. 0,75M
C. 0,25M
D. 0,5M
Đáp án D
A → An+
nFe + 2An+ → nFe2+ + 2A
2,2A/n - 5,6 = 12 -11,2 = 0,8→ A = 32n→A = 64 (Cu)
CM = 12,8/(64.0,4) = 0,5M
Đúng 0
Bình luận (0)
Nhúng một thanh sắt nặng 100 gam vào 100 ml dung dịch hỗn hợp gồm
C
u
N
O
3
2
0,2M và
A
g
N
O
3
0,2M. Sau một thời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 101,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh sắt). Tính khối lượng sắt đã phản ứng.
Đọc tiếp
Nhúng một thanh sắt nặng 100 gam vào 100 ml dung dịch hỗn hợp gồm C u N O 3 2 0,2M và A g N O 3 0,2M. Sau một thời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 101,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh sắt). Tính khối lượng sắt đã phản ứng.
Cho 12,8 gam kim loại A hóa trị II phản ứng hoàn toàn với khí Cl2 thu muối B. Hòa tan B vào nước thu được 400ml dung dịch C. Nhúng thanh sắt nặng 11,2 gam vào dung dịch C, sau một thời gian thấy kim loại A bám vào thanh sắt và khối lượng thanh sắt là 12,0 gam, nồng độ FeCl2 trong dung dịch là 0,25M. Xác định kim loại A và nồng độ mol của kim loại B trong dung dịch C.
Đọc tiếp
Cho 12,8 gam kim loại A hóa trị II phản ứng hoàn toàn với khí Cl2 thu muối B. Hòa tan B vào nước thu được 400ml dung dịch C. Nhúng thanh sắt nặng 11,2 gam vào dung dịch C, sau một thời gian thấy kim loại A bám vào thanh sắt và khối lượng thanh sắt là 12,0 gam, nồng độ FeCl2 trong dung dịch là 0,25M. Xác định kim loại A và nồng độ mol của kim loại B trong dung dịch C.
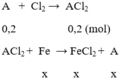
số mol FeCl2 là n = 0,25 . 0,4 = 0,1 (mol)
gọi x là số mol Fe phản ứng
khối lượng kim loại tăng là Δm = mA - mFe = Ax – 56x = 0,8
x = 0,1 → A.0,1 – 56.0,1 = 0,8 → A = 64. A là Cu
số mol Cu là nCu = 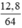 = 0,2 (mol)
= 0,2 (mol)
số mol CuCl2 → n(CuCl2) = nCu = 0,2 (mol)
nồng độ mol/l CuCl2 là C(M(CuCl2)) = 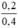 = 0,5M
= 0,5M
Đúng 0
Bình luận (0)
Nhúng một thanh sắt nặng 100 gam vào 100 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và AgNO3 0,2M. Sau một thời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 101,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh sắt). Tính khối lượng sắt đã phản ứng.
Nhúng một thanh sắt nặng 100 gam vào 100 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và AgNO3 0,2M. Sau một thời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 101,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh sắt). Tính khối lượng sắt đã phản ứng.
\(\left\{{}\begin{matrix}n_{Cu\left(NO_3\right)_2}=0,2.0,1=0,02\left(mol\right)\\n_{AgNO_3}=0,2.0,1=0,02\left(mol\right)\end{matrix}\right.\)
PTHH: Fe + 2AgNO3 --> Fe(NO3)2 + 2Ag
0,01<---0,02--------->0,01---->0,02
Fe + Cu(NO3)2 --> Fe(NO3)2 + Cu
a<--------a------------->a----->a
=> 100 - 56(0,01+a) + 0,02.108 + 64a = 101,72
=> a = 0,015
=> nFe = 0,015 + 0,01 = 0,025 (mol)
=> mFe = 0,025.56 = 1,4(g)
Đúng 4
Bình luận (0)
Nhúng một thanh kim loại kẻ nặng 50 gam vào dung dịch B có chứa đồng thời 4,56 gam FeSO4 12,48 gam CdSO4 Sau khi kết thúc tất cả các phản ứng lấy Thanh Zn ra cân lại thấy khối lượng thanh Zn tăng lên Xg giả sử tất cả kim loại thoát ra bám hết vào Zn tăng Xg
Câu 1: Nhúng thanh kim loại M vào 1lít dung dịch CuSO4 x mol/lít, kết thúc phản ứng thấy thanh kim loại M tăng 20g. Nếu cũng nhúng thanh kim loại trên vào 1 lít dung dịch FeSO4 x mol/lít, kết thúc phản ứng thì thấy thanh M tăng 16g. Vậy M là kim loại nào?Câu2: Cho 2 thanh kim loại R( hóa trị II) có cùng khối lượng. Nhúng thanh thứ nhất vào dung dịch Cu(NO3)2 và thanh thứ 2 vào dd Pb(NO3)2. Sau một thời gian khi số mol 2 muối bằng nhau, lấy 2 thanh kim loại đó ra khỏi dd thấy khối lượng thanh thứ...
Đọc tiếp
Câu 1: Nhúng thanh kim loại M vào 1lít dung dịch CuSO4 x mol/lít, kết thúc phản ứng thấy thanh kim loại M tăng 20g. Nếu cũng nhúng thanh kim loại trên vào 1 lít dung dịch FeSO4 x mol/lít, kết thúc phản ứng thì thấy thanh M tăng 16g. Vậy M là kim loại nào?
Câu2: Cho 2 thanh kim loại R( hóa trị II) có cùng khối lượng. Nhúng thanh thứ nhất vào dung dịch Cu(NO3)2 và thanh thứ 2 vào dd Pb(NO3)2. Sau một thời gian khi số mol 2 muối bằng nhau, lấy 2 thanh kim loại đó ra khỏi dd thấy khối lượng thanh thứ nhất giảm 0,2% còn khối lượng thanh thứ 2 tăng 28,4%. Nguyên tố R là ngtố nào?
Câu 3: Ngâm một vật bằng Cu có khối lượng 5g tring 250g dd AgNO3 4%. Khi lấy vật ra thì lượng AgNO3 trong dd đã giảm 17%. Khối lượng của vật sau phản ứng là bao nhiêu?
Câu4: Nhúng một thanh Zn vào 2lít dd chứa AgNO3 và Cu(NO3)2 có số mol bằng nhau, cho đến khi 2 muối trong dd phản ứng hết thì thu được dd A. Lấy thanh Zn đem cân lại, thấy khối lượng tăng 14,9 gam so với ban đầu. Nồng độ mol của dung dịch A?
Câu5: Nhúng 1 thang graphit được phủ một lớp kim loại hóa trị 2 vaò dd CuSO4 dư. Sau phản ứng khối lượng của thanh graphit giảm đi 0,24g. Cũng thanh graphit này nếu được nhúng vào dd AgNO3 thì khi phản ứng xong thấy khối lượng thanh graphit tăng lên 0,52 gam. Kim loại hóa trị 2 là?
Câu6: Nhúng một thanh kim loại X hóa trị 2 vào dd CuSO4 dư. Sau phản ứng khối lượng thanh kim loại giảm 0,12g. Mặt khác cũng thanh kim loại X đó được nhúng vào dd AgNO3 dư thì kết thúc phản ứng khối lượng thanh tăng 0,26g. Ngtố X là?
Câu 7: Cho 2 dd FeCl2 và CuSO4 có cùng nồng độ mol. - Nhúng thanh kim loại M hóa trị 2 vào 1lít dd FeCl2 sau phản ứng khối lượng thanh kim loạităng16g. - Nhúng cùng thanh kim loại ấy vào 1 lít dd CuSO4 sau phản ứng khối lượng thanh kim loại tăng 20g. Giả thiết các phản ứng xảy ra hoàn toàn và thanh kim loại M chưa bị tan hết. Kim loại M là?
Nhờ các bạn giúp với ạ. Mình đang cần gấp
Câu 1:
2M+nCuSO4\(\rightarrow\)M2(SO4)n+nCu
2M+nFeSO4\(\rightarrow\)M2(SO4)n+nFe
- Gọi a là số mol của M
- Độ tăng khối lượng PTHH1:
64na/2-Ma=20 hay(32n-M).a=20
- Độ tăng khối lượng PTHH2:
56.na/2-Ma=16 hay (28n-M)a=16
Lập tỉ số ta được:\(\dfrac{32n-M}{28n-M}=\dfrac{20}{16}=1,25\)
32n-M=35n-1,25M hay 0,25M=3n hay M=12n
n=1\(\rightarrow\)M=12(loại)
n=2\(\rightarrow\)M=24(Mg)
n=3\(\rightarrow\)M=36(loại)
Đúng 1
Bình luận (0)
Câu 2:Gọi A là khối lượng thanh R ban đầu.
R+Cu(NO3)2\(\rightarrow\)R(NO3)2+Cu
R+Pb(NO3)2\(\rightarrow\)R(NO3)2+Pb
- Gọi số mol Cu(NO3)2 và Pb(NO3)2 là x mol
- Độ giảm thanh 1: \(\dfrac{\left(R-64\right)x}{A}.100=0,2\)
- Độ tăng thanh 2: \(\dfrac{\left(207-R\right)x}{A}.100=28,4\)
Lập tỉ số: \(\dfrac{207-R}{R-64}=\dfrac{28,4}{0,2}=142\)
207-R=142R-9088 hay 143R=9295 suy ra R=65(Zn)
Đúng 1
Bình luận (0)
Câu 3:
Cu+2AgNO3\(\rightarrow\)Cu(NO3)2+2Ag
\(m_{AgNO_3}=\dfrac{250.4}{100}=10g\)
\(m_{AgNO_3}\left(pu\right)=\dfrac{17.10}{100}=1.7g\)
\(n_{AgNO_3}\left(pu\right)=\dfrac{17.}{170}=0,1mol\)
Độ tăng khối lượng=108.0,1-64.0,1:2=7,6g
Khối lượng thanh Cu=5+7,6=12,6g
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Nhúng thanh kim loại Mg có khối lượng m gam vào dung dịch chứa 0,2 mol CuSO4, sau một thời gian lấy thanh kim loại ra, thấy khối lượng CuSO4đã tham gia phản ứng là 80%. Thanh kim loại sau khi lấy ra đem đốt cháy trong O2dư, thu được (m + 12,8) gam chất rắn (cho rằng Cu giải phóng bám hết vào thanh Mg). Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch CuSO4 là A. 10,24 gam B. 12,00 gam C. 16,00 gam D. 9,60 gam
Đọc tiếp
Nhúng thanh kim loại Mg có khối lượng m gam vào dung dịch chứa 0,2 mol CuSO4, sau một thời gian lấy thanh kim loại ra, thấy khối lượng CuSO4đã tham gia phản ứng là 80%. Thanh kim loại sau khi lấy ra đem đốt cháy trong O2dư, thu được (m + 12,8) gam chất rắn (cho rằng Cu giải phóng bám hết vào thanh Mg). Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch CuSO4 là
A. 10,24 gam
B. 12,00 gam
C. 16,00 gam
D. 9,60 gam

Số mol: 0,16......0,16.............................0,16
Sau phản ứng với dung dịch CuSO4 khối lượng thanh kim loại là
![]()
Thanh kim loại sau khi lấy ra có x mol Mg dư và 0,16 mol Cu
Khi đốt trong oxi dư:
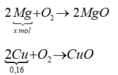
mO2 = (m + 12,8) – (m + 6,4) = 6,4 → nO2 = 0,2 mol
0,5 x + 0,08 = 0,2 → x = 0,24 mol
Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch CuSO4 là
0,24 . 24 + 0,16 . 64 = 16 gam
Đáp án C
Đúng 0
Bình luận (0)











