Y là một oxit kim loại chứa 70% kim loại về khối lượng . Tìm công thức phân tử của Y.

Những câu hỏi liên quan
Một oxit kim loại chứa 52,94% kim loại (về khối lượng). Hãy XĐ công thức phân tử của oxit đó
CTHH: RxOy
Có \(\%R=\dfrac{x.M_R}{x.M_R+16y}.100\%=52,94\%=>M_R=9.\dfrac{2y}{x}\)(g/mol)
Xét \(\dfrac{2y}{x}=1=>L\)
Xét \(\dfrac{2y}{x}=2=>L\)
Xét \(\dfrac{2y}{x}=3=>M_R=27\left(Al\right)=>\dfrac{x}{y}=\dfrac{2}{3}=>Al_2O_3\)
Đúng 1
Bình luận (0)
1.Oxit cao nhất của 1 nguyên tố R có dạng R2Ox. Phân tử khối của oxit là 102 đvC. Xác định R.
2. Cho biết phân tử khối của một oxit kim loại là 160, phần trăm khối lượng của kim loại trong
oxit là 70%. Lập công thức oxit đó.
1)
PTKR2Ox = 2.NTKR + 16x = 102 (đvC)
| x | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| NTKR | 43(Loại) | 35(Loại) | 27(Al) | 19(Loại) | 11(Loại) | 3(Loại) | Loại | Loại |
=> R là Al
2)
CTHH: RxOy
\(\%R=\dfrac{x.NTK_R}{160}.100\%=70\%\)
=> \(NTK_R=\dfrac{112}{x}\left(đvC\right)\)
Chỉ có x = 2 thỏa mãn \(NTK_R=\dfrac{112}{2}=56\left(đvC\right)\)
=> R là Fe
PTKFe2Oy = 160 (đvC)
=> y = 3
CTHH: Fe2O3
Đúng 2
Bình luận (0)
1/ Trong tinh thể ngậm nước của một muối sunfat kim loại hóa trị (II), nước kết tinh là 45,32% về khối lượng. Xác định công thức phân tử của tinh thể, biết tinh thể chứa 11,51% là lưu huỳnh về khối lượng.
2/Y là một oxit kim loại chứa 70% kim loại về khối lượng . Tìm công thức phân tử của Y.
1/ CTHH dạng TQ là ASO4 . xH2O
*Có : %S/muối tinh thể = \(\dfrac{1.M_S}{M_{ASO4.xH2O}}.100\%=11,51\%\)
=> \(\dfrac{32}{M_{ASO4.xH2O}}=0,1151\)
=> MASO4.xH2O = 278(g)
* Có : %H2O/muối tinh thể = \(\dfrac{x.M_{H2O}}{M_{ASO4.xH2O}}.100\%=45,32\%\)
=> \(\dfrac{x.18}{278}=0,4532\)
=>x= 7
*Lại có : MASO4.xH2O = 278
mà x = 7
=> MA + 96 + 7 .18=278 => MA =56(g) => A là Sắt (Fe)
Vậy CTPT của tinh thể là FeSO4 .7H2O
Đúng 1
Bình luận (0)
Cho biết khối lượng mol của một oxit kim loại là 160gam, thành phần về khối lượng của kim loại trong oxit đó là 70%. Lập công thức hóa học của oxit. Gọi tên oxit kim loại đó.
Đặt công thức của oxit kim loại là MxOy
%mO = 100% - 70% = 30%
⇒ mO = 12y = 160.30% = 48
⇒ y = 3
mM = 160.70% = 112g = M.x (với M là phân tử khối của kim loại M)
Áp dụng quy tắc hóa trị ta có:
a.x = 2.3 = 6 (với a là hóa trị của M; a = 1; 2; 3)
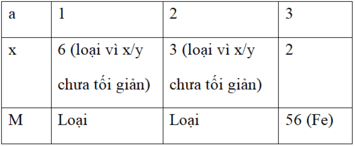
⇒ M là kim loại Sắt.
Vậy công thức hóa học của oxit kim loại là Fe2O3 (Sắt (III) oxit).
Đúng 2
Bình luận (0)
Cho biết phân tử của 1 oxit kim loại là 160g, % theo khối lượng của km loại trong oxit là 70%. Lập công thức oxit đó.
Gọi CTTQ của oxit kim loại là R2On.
Có: 2R + 16n = 160 (1)
Lại có %R = 2R/2R + 16n = 70% <=> 2R = 160 . 70% => R = 56 (Fe)
Thay R = 56 vào (1): 2 . 56 + 16n = 160 => n = 3
Vậy công thức oxit cần tìm là Fe2O3.
Đúng 1
Bình luận (0)
Oxit của kim loại hóa trị III có chứa 70% oxi về khối lượng tìm công thức hóa học của oxit nói trên
Sửa đề : 70% kim loại
\(CT:A_2O_3\)
\(\%A=\dfrac{2A}{2A+16\cdot3}\cdot100\%=70\%\)
\(\Leftrightarrow A=56\)
\(CT:Fe_2O_3\)
Đúng 6
Bình luận (0)
Gọi CTHH của oxit là M2O3
Ta có %mM = 70%
=> \(\dfrac{2.M_M}{2.M_M+3.16}.100\%=70\%\Rightarrow M_M=56\left(Fe\right)\)
Vậy cthh của oxit là Fe2O3
Bài này phải là 30% oxi về khối lượng thì đúng hơn
Đúng 2
Bình luận (0)
Cho biết khối lượng mol một oxit của kim loại là 160 g/mol, thành phần về khối lượng của kim loại trong oxit đó là 70%. Lập công thức hóa học của oxit. Gọi tên oxit đó
\(CT:M_xO_y\)
\(\%M=\dfrac{xM}{160}\cdot100\%=70\%\)
\(\Rightarrow xM=112\)
\(\text{Với : }\) \(x=2\Rightarrow M=56\)
\(M=56\cdot2+16y=160\left(g\text{/}mol\right)\)
\(\Rightarrow y=3\)
\(CT:Fe_2O_3:\text{Sắt (III) oxit}\)
Đúng 4
Bình luận (0)
Cho biết khối lượng mol một oxit của kim loại là 160g/mol, thành phần về khối lượng của kim loại trong oxit đó là 70%. Lập công thức hoá học của oxit. Gọi tên oxit đó.
Cho biết khối lượng mol của một oxit của kim loại là 160 g/mol, thành phần về khối lượng của kim loại trong oxit đó là 70. Lập công thức hóa học của oxit. Gọi tên oxit đó.
Khối lượng của kim loại có trong oxit kim loại:
MKL = 112 g
Khối lượng nguyên tố oxi: mO = 160 – 112 = 48g
Đặt công thức hóa học của oxit kim loại là MxOy, ta có:
MKL. x = 112 => nếu x = 2 thì M = 56. Vậy M là Fe
16y = 48 => y = 3
Vậy CTHH: Fe2O3, đó là sắt (III) oxit
Đúng 0
Bình luận (0)
Hoan hô , Học sinh tự hỏi tự trả lời
Hoan hô oooooooooooooooooooooooooooo
Đúng 2
Bình luận (0)





















