Viết phương trình hoá học của cacbon với các oxit sau:
a/CuO, b/PbO c/CO2 d/FeO
Hãy cho biết các loại phản ứng: Vai trò của C trong các phản ứng, ứng dụng của các phản ứng đó trong sản xuất
Viết phương trình hoá học của cacbon với các oxit sau:
a) CuO ; b) PbO ; c) CO2; d) FeO.
Hãy cho biết loại phản ứng ; vai trò của C trong các phản ứng ; ứng dụng của các phản ứng đó trong sản xuất.
Các phương trình hóa học:

Các phản ứng trên dều thuộc loại phản ứng oxi hóa – khử. Vai trò của с là chất khử. Các phản ứng:
a), b) dùng điều chế kim loại.
c), d) xảy ra trong quá trình luyện gang, dùng luyện gang.
Viết phương trình hoá học của cacbon với các oxit sau:
a) CuO ; b) PbO ; c) CO2; d) FeO.
Hãy cho biết loại phản ứng ; vai trò của C trong các phản ứng ; ứng dụng của các phản ứng đó trong sản xuất.
Các phương trình hóa học:
a) С + 2CuO 2Cu + CO2
b) С + 2PbO 2Pb + CO2
c) С + CO2 2CO
d) С + 2FeO 2Fe + CO2
Các phản ứng trên dều thuộc loại phản ứng oxi hóa - khử. Vai trò của с là chất khử. Các phản ứng:
a), b) dùng điều chế kim loại.
c), d) xảy ra trong quá trình luyện gang, dùng luyện gang.
Viết phương trình hoá học của các phản ứng sau và cho biết tính chất hoá học của cacbon (là chất oxi hoá hay chất khử)
(1) C + CO 2 → t ° CO
(2) C + Fe 2 O 3 → t ° Fe + CO
(3) C + CaO → t ° CaC 2 + CO
(4) C + PbO → t ° Pb + CO 2
(5) C + CuO → t ° Cu + CO 2
(1) C + CO2 to→ 2CO (2) 3C + Fe2O3 to→ 2Fe + 3CO (3) 3C + CaO to→ CaC2 + CO (4) C + 2PbO to→ 2Pb + CO2 (5) C + 2CuO to→ 2Cu + CO2
Trong các phản ứng trên C là chất khử
Nung nóng 19,15 gam hỗn hợp CuO và PbO với một lượng cacbon vừa đủ trong môi trường không có oxi để oxit kim loại bị khử hết. Toàn bộ lượng khí sinh ra được dẫn vào dung dịch Ca OH 2 dư, phản ứng xong người ta thu được 7,5 gam chất kết tủa màu trắng. Viết phương trình hoá học của các phản ứng đã xảy ra
Phương trình hóa học:
2CuO + C → 2Cu + CO 2
2PbO + C → 2Pb + CO 2
CO 2 + Ca OH 2 → CaCO 3 + H 2 O
n CaCO 3 = 7,5/100 = 0,075
n C u O = x; n P b O = y
Dẫn dòng khí H2 dư qua hỗn hợp gồm 2,23g PbO và 3,2g CuO ở nhiệt độ cao
a/ Viết phương trình hóa học của các phản ứng?
b/ Cho biết vai trò của H2.
c/ Tính khối lượng kim loại Cu và Pb thu được spư.
d/ tính số mol H2 đã tham gia các pư.
Vai trò của H2 là chất khử oxi
nPbO = 2,23/223 = 0,01 (mol)
nCuO = 3,2/80 = 0,04 (mol)
PTHH:
PbO + H2 -> (t°) Pb + H2O
0,01 ---> 0,01 ---> 0,01
CuO + H2 -> (t°) Cu + H2O
0,04 ---> 0,04 ---> 0,04
mPb = 0,01 . 217 = 2,17 (g)
mCu = 0,04 . 64 = 2,56 (g)
nH2 = 0,04 + 0,01 = 0,05 (mol)
Lập phương trình hoá học của các phản ứng sau và cho biết các phản ứng trên thuộc loại phản ứng nào?
a/ Sắt (III) oxit + hiđro -> sắt + nước
b/ Lưu huỳnh trioxit + nước -> axit sunfuric
c/ Nhôm + sắt (III)oxit -> sắt + nhôm oxit
d/ Canxi oxit + nước -> canxi hiđroxit
e/ Kali + nước -> kali hiđroxit + khí hiđro
f/ Kẽm + axit sufuric (loãng) -> kẽm sunfat + khí hiđro
a) Fe2O3 + 3H2 → 2Fe + 3H2O (phản ứng thế)
b) SO3 + H2O → H2SO4 (phản ứng hoá hợp)
c) 2Al + Fe2O3 → 2Fe + Al2O3 (phản ứng thế)
d) CaO + H2O → Ca(OH)2 (phản ứng hoá hợp)
e) 2K + 2H2O → 2KOH + H2 (phản ứng thế)
f) Zn + H2SO4 → ZnSO4 + H2 (phản ứng thế)
Ở nhiệt độ cao cacbon có thể phản ứng với nhiều đơn chất và hợp chất. Hãy lập các phương trình hoá học sau đây và cho biết ở phản ứng nào cacbon thể hiện tính khử. Ghi rõ số oxi hoá của cacbon trong từng phản ứng.
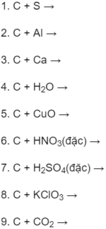
Hãy cho biết trong những phản ứng oxi hoá học xảy ra quanh ta sau đây, phản ứng nào là phản ứng oxi hoá – khử? Lợi ích và tác hại của mỗi phản ứng?
a. Đốt than trong lò: C + O 2 − t o → C O 2
b. Dùng cacbon oxit khử sắt (III) oxit trong luyên kim: F e 2 O 3 + 3 C O − t o → 2 F e + 3 C O 2
c. Nung vôi: C a C O 3 − t o → C a O + C O 2
d. Sắt bị gỉ trong không khí: 4 F e + 3 O 2 − t o → 2 F e 2 O 3 .
Phản ứng oxi hoá – khử: đốt than trong lò, dùng cacbon oxit khử sắt(III) oxit trong luyện kim, sắt bị gỉ trong không khí.
Phản ứng a có lợi: sinh ra nhiệt để sản xuất, phục vụ đời sống; tác hại: tạo ra khí C O 2 làm ô nhiễm môi trường.
Phản ứng b có lợi: luyện quặng sắt thành sắt, điều chế sắt; tác hại: sinh ra khí C O 2 làm ô nhiễm môi trường.
Phản ứng d có hại: làm sắt bị gỉ dẫn đến hư hại các công trình xây dựng, các dụng cụ và đồ dùng bằng sắt.
Viết phương trình hoá học biểu diễn các biến hoá sau và cho biết mỗi phản ứng đó thuộc loại phản ứng nào?
a) Na → \(Na_2O\) → NaOH
b) P → \(P_2O_5\) → \(H_3PO_4\) → \(Mg_3\left(PO_4\right)_2\)
c) \(KMnO_4\) → \(O_2\) → CuO → \(H_2O\) → KOH
d) CuO → \(Ca\left(OH\right)_2\) → \(CaCO_3\)
a)\(4Na+O_2\underrightarrow{t^o}2Na_2O\)
\(Na_2O+H_2O\rightarrow2NaOH\)
b)\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
\(2H_3PO_4+3MgO\rightarrow Mg_3\left(PO_4\right)_2+3H_2O\)
c)\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
\(CuO+H_2\rightarrow Cu+H_2O\)
\(H_2O+K_2O\rightarrow2KOH\)