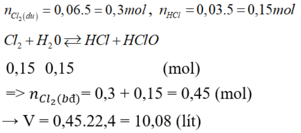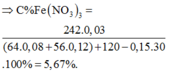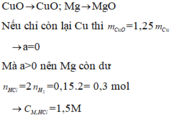Trong 1 loại nước ta thấy nồng độ Cl2 là 0,061M còn nồng độ của HCl và HClO là 0,03 M . Hỏi phải hòa tan bao nhiêu lít khí Cl2 ( đktc) vào nước để thu đc 5 lít nc Clo như trên.

Những câu hỏi liên quan
Một loại nước clo chứa : Cl2 0,061M ; HCl 0,03M và HClO 0,03M. a) Viết phương trình phản ứng của Cl2 với H2O b) Thể tích khí clo (đktc) để thu được 5 lít nước clo trên ?
a)Cl2+H2O->HCl+HClO
=>Do dùng dư Cl2
n Cl2=5.(0,061+0,06)=0,605 mol
VCl2 candung= 0,605.22,4=13,552l
Đúng 2
Bình luận (0)
Trong một loại nước clo ở 25
°
C
, người ta xác định được nồng độ của clo là 0,06M còn nồng độ của HCl và HClO đều là 0,03M. Thể tích khí clo (đktc) cần dùng để điều chế 5 lít nước clo trên là A. 6,72 lít. B. 3,36 lít. C. 10,08 lít. D. 13,44 lít.
Đọc tiếp
Trong một loại nước clo ở 25 ° C , người ta xác định được nồng độ của clo là 0,06M còn nồng độ của HCl và HClO đều là 0,03M. Thể tích khí clo (đktc) cần dùng để điều chế 5 lít nước clo trên là
A. 6,72 lít.
B. 3,36 lít.
C. 10,08 lít.
D. 13,44 lít.
Cho 8,96 lít khí H2 phản ứng với 7,84 lít khí Cl2 thu được V lít khí A. (thể tích các khí đo ở đktc)
a. Giá trị V = ?
b. Hòa tan lượng khí A trên vào 224,45gam nước thu được dung dịch B. Tính nồng độ % của dung dịch B
H2+Cl2->2HCl
0,35---0,7 mol
n H2=\(\dfrac{8,96}{22,4}\)=0,4 mol
n Cl2=\(\dfrac{7,84}{22,4}\)=0,35 mol
=>H2 dư :0,05 mol
=>VHCl=0,7.22,4=15,68l
b) C% HCl=\(\dfrac{0,7.36,5}{25,55+224,45}\).100=10,22%
Đúng 4
Bình luận (2)
a: \(H_2+Cl_2\rightarrow2HCl\)
\(n_{H_2}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(n_{Cl_2}=\dfrac{7.84}{22.4}=0.35\left(mol\right)\)
=>Cl2 thiếu, H2 dư
\(V_{HCl}=2\cdot V_{Cl_2}=0.7\left(mol\right)\)
Đúng 0
Bình luận (1)
Đốt cháy m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl2 và O2 thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng thu được dung dịch Z chứa 2 muối. Cho AgNO3 dư vào dung dịch Z thu được 73,23 gam kết tủa. Mặt khác hòa tan hết m gam hỗn hợp X trên trong dung dịch HNO3 31,5% thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất, đktc). Nồng độ C% của Fe(NO3) trong dung dịch T là A. 4,63%. B...
Đọc tiếp
Đốt cháy m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl2 và O2 thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng thu được dung dịch Z chứa 2 muối. Cho AgNO3 dư vào dung dịch Z thu được 73,23 gam kết tủa. Mặt khác hòa tan hết m gam hỗn hợp X trên trong dung dịch HNO3 31,5% thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất, đktc). Nồng độ C% của Fe(NO3) trong dung dịch T là
A. 4,63%.
B. 5,18%.
C. 5,48%.
D. 5,67%.
Đốt chat m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl2 và O2 thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng thu được dung dịch Z chứa 2 muối. Cho AgNO3 dư vào dung dịch Z thu được 73,23 gam kết tủa. Mặt khác hòa tan hết m gam hỗn hợp X trên vào dung dịch HNO3 31,5% thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất; đktc). Nồng độ C% của Fe(NO3)3 có trong dung dịch T gần đúng nhất...
Đọc tiếp
Đốt chat m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl2 và O2 thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng thu được dung dịch Z chứa 2 muối. Cho AgNO3 dư vào dung dịch Z thu được 73,23 gam kết tủa. Mặt khác hòa tan hết m gam hỗn hợp X trên vào dung dịch HNO3 31,5% thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất; đktc). Nồng độ C% của Fe(NO3)3 có trong dung dịch T gần đúng nhất với:
A. 5%
B. 7%
C. 8%
D. 9%
Đáp án A
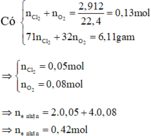
Y + HCl => Z chỉ chứa hai muối, HCl phản ứng hết
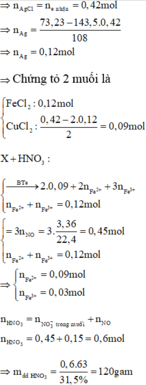
⇒ m dd T = 120 + 64 . 0 , 09 + 56 . 0 , 12 - 30 . 0 , 15 = 127 , 98 gam ⇒ C % Fe NO 3 3 = 242 . 0 , 03 127 , 98 . 100 % = 5 , 67 %
gần với giá trị 5% nhất
Đúng 0
Bình luận (0)
Câu 5: Hòa tan hoàn toàn 4g muối cacbonat của kim loại hóa trị II của dung dịch HCl thì thu đc 0,896 lít khí (đktc). Tìm CTHH của muối.
Câu 6: Hòa tan 3,1g Na2O vào nước đc 200ml dung dịch A. Tính nồng độ mCl dung dịch A.
giúp mk vs ạ mk cần gấp
Câu 5:
\(n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
PTHH: ACO3 + 2HCl --> ACl2 + CO2 + H2O
_____0,04<-----------------------0,04
=> \(M_{ACO_3}=\dfrac{4}{0,04}=100\left(g/mol\right)\)
=> MA 40 (g/mol)
=> A là Ca => CTHH của muối là CaCO3
Câu 6:
\(n_{Na_2O}=\dfrac{3,1}{62}=0,05\left(mol\right)\)
PTHH: Na2O + H2O --> 2NaOH
______0,05--------------->0,1
=> \(C_M=\dfrac{0,1}{0,2}=0,5M\)
Đúng 1
Bình luận (0)
Hòa tan hỗn hợp Mg, Cu bằng 200ml HCl thu được 3,36 lít khí (đktc) và m gam còn lại kim loại không tan. Oxi hóa hoàn toàn m gam kim loại trên thu được 1,25m + a gam oxit (a 0). Nồng độ HCl và các kim loại dư sau phản ứng là A. 1,5M Mg, Cu B. 2,5M Cu C. 1,5M Cu D. 2M Mg, Cu
Đọc tiếp
Hòa tan hỗn hợp Mg, Cu bằng 200ml HCl thu được 3,36 lít khí (đktc) và m gam còn lại kim loại không tan. Oxi hóa hoàn toàn m gam kim loại trên thu được 1,25m + a gam oxit (a > 0). Nồng độ HCl và các kim loại dư sau phản ứng là
A. 1,5M Mg, Cu
B. 2,5M Cu
C. 1,5M Cu
D. 2M Mg, Cu
Hoà tan hoàn toàn 5,8 gam hỗn hợp gồm kim loại M và oxit của nó vào nước, thu được 1 lít dung dịch chứa một chất tan có nồng độ 0,04M và 0,448 lít khí H2 (đktc). Kim loại M là A. Na. B. Ba. C. Ca. D. K.
Đọc tiếp
Hoà tan hoàn toàn 5,8 gam hỗn hợp gồm kim loại M và oxit của nó vào nước, thu được 1 lít dung dịch chứa một chất tan có nồng độ 0,04M và 0,448 lít khí H2 (đktc). Kim loại M là
A. Na.
B. Ba.
C. Ca.
D. K.
Chọn B.
Hỗn hợp 5,8 gam có M (a mol) và M2Ox (b mol) Þ Ma + (2M + 16x).b = 5,8 (1)
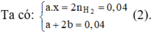
Với x = 1 hoặc 2 thay vào (1), (2) suy ra M = 137 (Ba)
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn 5,8 gam hỗn hợp gồm kim loại M và oxit của nó vào nước, thu được 1 lít dung dịch chứa một chất tan có nồng độ 0,04M và 0,448 lít khí H2 (đktc). Kim loại M là A. Na B. Ba C. Ca. D. K
Đọc tiếp
Hoà tan hoàn toàn 5,8 gam hỗn hợp gồm kim loại M và oxit của nó vào nước, thu được 1 lít dung dịch chứa một chất tan có nồng độ 0,04M và 0,448 lít khí H2 (đktc). Kim loại M là
A. Na
B. Ba
C. Ca.
D. K