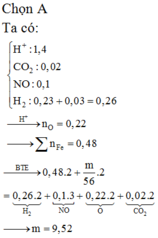cho hỗn hợp bột kim loại A gồm 0,02 mol Fe; 0,04mol Al;0,03 mol Cu và 0,01 mol Zn hòa tan hết vào dung dịch HNO3 thu được V lít hỗn hợp khí gồm NO và N2O có tỉ khối so với khí Hiđrô là 16,75.Tính V.

Những câu hỏi liên quan
Hòa tan hoàn toàn hỗn hợp X gồm Cu, Fe, Mg vào dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y chỉ chứa muối của kim loại và hỗn hợp khí gồm 0,01 mol N2, 0,02 mol NO. Số mol HNO3 đã phản ứng là A. 0,10 B. 0,12 C. 0,16 D. 0,20
Đọc tiếp
Hòa tan hoàn toàn hỗn hợp X gồm Cu, Fe, Mg vào dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y chỉ chứa muối của kim loại và hỗn hợp khí gồm 0,01 mol N2, 0,02 mol NO. Số mol HNO3 đã phản ứng là
A. 0,10
B. 0,12
C. 0,16
D. 0,20
Ở ví dụ 4, ta đã giải quyết câu hỏi này bằng bảo toàn nguyên tố, giờ với phương trình liên hệ mol H+ và sản phẩm khử, ta có ngay: nH+ = 12nN2 + 4nNO = 12.0,01 + 4.0,02 =0,2 mol
Chọn đáp án D
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn hỗn hợp X gồm Cu, Fe, Mg vào dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y chỉ chứa muối của kim loại và hỗn hợp khí gồm 0,01 1mol N2, 0,02 mol NO. Số mol HNO3 đã phản ứng là A. 0,10 B. 0,12 C. 0,16 D. 0,20
Đọc tiếp
Hòa tan hoàn toàn hỗn hợp X gồm Cu, Fe, Mg vào dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y chỉ chứa muối của kim loại và hỗn hợp khí gồm 0,01 1mol N2, 0,02 mol NO. Số mol HNO3 đã phản ứng là
A. 0,10
B. 0,12
C. 0,16
D. 0,20
Cho 13 g hỗn hợp A gồm Fe, Mg, Zn phản ứng với 1,2 mol HCl
a.Chứng tỏ rằng A tan hết
b. Nếu tổng số mol của 3 kim loại trong 13 g hỗn hợp A là 0,3 mol, tỉ lệ số mol giữa Fe và Mg là 1:1. Tính khối lượng mỗi kim loại trong hỗn hợp A
Để loại bỏ kim loại Fe ra khỏi hỗn hợp bột gồm Fe và Cu, người ta ngâm hỗn hợp kim loại trên vào lượng dư dung dịch A.
A
g
N
O
3
B.
H
N
O
3
c.
C
u
N
O
3
2
D.
F
e
N...
Đọc tiếp
Để loại bỏ kim loại Fe ra khỏi hỗn hợp bột gồm Fe và Cu, người ta ngâm hỗn hợp kim loại trên vào lượng dư dung dịch
A. A g N O 3
B. H N O 3
c. C u N O 3 2
D. F e N O 3 2
Hòa tan hết 31,6 gam hỗn hợp gồm Fe, FeO, Fe3O4, FeCO3 trong dung dịch chứa 0,1 mol NaNO3 và 0,7 mol H2SO4 được 7,84 lít hỗn hợp khí X có chứa H2, NO và 0,02 mol khí CO2 có khối lượng là 4,34 và dung dịch Y. Cho bột Fe dư vào dung dịch Y thì thấy có m gam bột Fe phản ứng và thoát ra 0,03 mol khí H2. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là. A. 9,52 B. 11,20 C. 10,64 D. 12,32
Đọc tiếp
Hòa tan hết 31,6 gam hỗn hợp gồm Fe, FeO, Fe3O4, FeCO3 trong dung dịch chứa 0,1 mol NaNO3 và 0,7 mol H2SO4 được 7,84 lít hỗn hợp khí X có chứa H2, NO và 0,02 mol khí CO2 có khối lượng là 4,34 và dung dịch Y. Cho bột Fe dư vào dung dịch Y thì thấy có m gam bột Fe phản ứng và thoát ra 0,03 mol khí H2. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là.
A. 9,52
B. 11,20
C. 10,64
D. 12,32
Cho hỗn hợp dạng bột gồm 4 kim loại Al Cu Fe Ag bằng phương pháp hóa học hãy tách riêng từng kim loại ra khỏi hỗn hợp
Cho 2,44 gam hỗn hợp A gồm 3 kim loại Mg , Fe , và Cu ( ở dạng bột ) vào dung dịch loãng có chứa 0,05 mol H2SO4 . Sau khi phản ứng xảy ra hoàn toàn , thấy thoát ra 0,784 lít khí H2 ( đktc) và hỗn hợp B . Đem lọc , rửa B thu được 1,28 gam chất rắn
a, Viết phương trình các phản ứng xảy ra .
b, Tính % khôid lượng mỗi kim loại có trong hỗn hợp A
a)
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
b) Chất rắn không tan là Cu $\Rightarrow m_{Cu} = 1,28(gam)$
Gọi $n_{Mg} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 24a + 56b + 1,28 = 2,44(1)$
Theo PTHH :
$n_{H_2} = a + b = \dfrac{0,784}{22,4} = 0,035(2)$
Từ (1)(2) suy ra : a = 0,025 ; b = 0,01
$\%m_{Mg} = \dfrac{0,025.24}{2,44}.100\% = 24,6\%$
$\%m_{Fe} = \dfrac{0,01.56}{2,44}.100\% = 23\%$
$\%m_{Cu} = 100\% - 24,6\% - 23\% = 52,4\%$
Đúng 2
Bình luận (0)
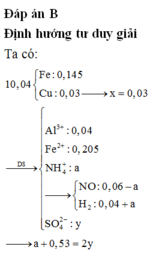
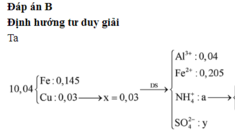
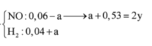
Cho hỗn hợp gồm 0,04 mol Al và 0,35 mol Fe tác dụng với dd chứa hỗn hợp gồm x mol Cu(NO3)2 và y mol H2SO4, thu được 2,24 lít (đktc) hỗn hợp hai khí (gồm NO và H2), dung dịch chứa m gam muối và 10,04 gam hỗn hợp hai kim loại (trong đó kim loại mạnh hơn chiếm 80,88% khối lượng). Giá trị của (y – x ) là A. 0,26 B. 0,25 C. 0,23 D. 0,22
Đọc tiếp
Cho hỗn hợp gồm 0,04 mol Al và 0,35 mol Fe tác dụng với dd chứa hỗn hợp gồm x mol Cu(NO3)2 và y mol H2SO4, thu được 2,24 lít (đktc) hỗn hợp hai khí (gồm NO và H2), dung dịch chứa m gam muối và 10,04 gam hỗn hợp hai kim loại (trong đó kim loại mạnh hơn chiếm 80,88% khối lượng). Giá trị của (y – x ) là
A. 0,26
B. 0,25
C. 0,23
D. 0,22
Cho hỗn hợp gồm 0,04 mol Al và 0,35 mol Fe tác dụng với dd chứa hỗn hợp gồm x mol Cu(NO3)2 và y mol H2SO4, thu được 2,24 lít (đktc) hỗn hợp hai khí (gồm NO và H2), dung dịch chứa m gam muối và 10,04 gam hỗn hợp hai kim loại (trong đó kim loại mạnh hơn chiếm 80,88% khối lượng). Giá trị của (y – x ) là A. 0,26. B. 0,25. C. 0,23. D. 0,22.
Đọc tiếp
Cho hỗn hợp gồm 0,04 mol Al và 0,35 mol Fe tác dụng với dd chứa hỗn hợp gồm x mol Cu(NO3)2 và y mol H2SO4, thu được 2,24 lít (đktc) hỗn hợp hai khí (gồm NO và H2), dung dịch chứa m gam muối và 10,04 gam hỗn hợp hai kim loại (trong đó kim loại mạnh hơn chiếm 80,88% khối lượng). Giá trị của (y – x ) là
A. 0,26.
B. 0,25.
C. 0,23.
D. 0,22.