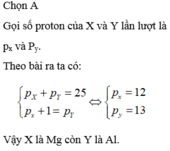hai nguyên tố A,B đứng kế tiếp nhau trong cùng 1 chu kì , có tổng số p trong 2 hạt nhân là 49.Xđ A,B

Những câu hỏi liên quan
hai nguyên tố a và b đứng kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn .tổng số diện tích hạt nhân của a và b là 23 .xác định a và b .viết cấu hình electron nguyên tử của a và b
\(\left\{{}\begin{matrix}z_A+z_B=23\\z_B-z_A=1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}z_A=11\\z_B=12\end{matrix}\right.\)
=> A là Na: \(1s^22s^22p^63s^1\) thu gọn \(\left[Ne\right]3s^1\)
=> B là Mg: \(1s^22s^22p^63s^2\)
Đúng 1
Bình luận (0)
Hai nguyên tố A, B đứng kế tiếp nhau trong một chu kì của bảng tuần hoàn có tổng số đơn vị điện tích hạt nhân là 25. Xác định tên 2 nguyên tố
A. Al, Mg
B. Na, Mg
C. K, Ca
D.Na, K
Đáp án A
Gọi số điện tích hạt nhân của nguyên tố A là ZA, số điện tích hạt nhân của nguyên tố B là ZB. Theo đề bài ta có
![]()
Đúng 1
Bình luận (0)
A và B là hai nguyên tố liên tiếp nhau trong cùng một chu kì (
Z
A
Z
B
). Tổng số proton trong hạt nhân hai nguyên tử A và B bằng 49. Vị trí của A trong bảng tuần hoàn là A. chu kì 4, nhóm IB. B. chu kì 4, nhóm IIA. C.chu kì 4, nhóm VIB. D. chu kì 3, nhóm IIB.
Đọc tiếp
A và B là hai nguyên tố liên tiếp nhau trong cùng một chu kì ( Z A < Z B ). Tổng số proton trong hạt nhân hai nguyên tử A và B bằng 49. Vị trí của A trong bảng tuần hoàn là
A. chu kì 4, nhóm IB.
B. chu kì 4, nhóm IIA.
C.chu kì 4, nhóm VIB.
D. chu kì 3, nhóm IIB.
Câu 2 : A và B là 2 nguyên tố liên tiếp nhau trong cùng một chu kì. Tổng số p trong hai hạt nhân là 49. Viết cấu hình electron và xác định vị trí của A, B trong bảng tuần hoàn?
Câu 1. Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì có tổng số proton trong hai hạt nhân nguyên tử là 25. X và Y thuộc chu kì và các nhóm nào?
Giả sử X đứng trước Y
Ta có : \(\left\{{}\begin{matrix}P_X+P_Y=25\\P_X+1=P_Y\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}P_X=12\left(Mg\right)\\P_Y=13\left(Al\right)\end{matrix}\right.\)
=> X và Y thuộc chu kì 3
X thuộc nhóm IIA và Y thuộc nhóm IIIA
Đúng 1
Bình luận (0)
Gọi số hạt proton của một nguyên tử nguyên tố là a
Suy ra số hạt proton của nguyên tử nguyên tố còn lại là a + 1
Ta có : $a + a + 1 = 25 \Rightarrow a = 12$
Vậy X là Magie, Y là Nhôm
Do đó, X thuộc nhóm IIA, Y thuộc nhóm IIIA
Đúng 1
Bình luận (0)
Câu 4 : Hai nguyên tố A, B đứng kế tiếp nhau trong cùng một chu kì trong bảng tuần hoàn, có tổng điện tích hạt nhân là 25.
a. Xác định vị trí của A, B trong bảng tuần hoàn, viết cấu hình electron của A, B.
b. So sánh tính chất hóa học của A và B; tính bazơ của oxit tạo thành từ A và B.
Hai nguyên tố X và Y kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn có tổng số điện tích hạt nhân là 39. X và Y là (biết X đứng trước Y) A.
C
24
r
v
à
P
15
.
B.
O
8
v
à
C
17
l
.
C....
Đọc tiếp
Hai nguyên tố X và Y kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn có tổng số điện tích hạt nhân là 39. X và Y là (biết X đứng trước Y)
A. C 24 r v à P 15 .
B. O 8 v à C 17 l .
C. M 12 g v à A 13 l .
D. K 19 v à C 20 a .
Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì và có tổng số proton trong hai hạt nhân là 25, trong đó X có số proton nhở hơn Y. Hai nguyên tố X và Y lần lượt là
A. Mg và Al.
B. Al và Mg.
C. F và Cl.
D. Cl và F.
Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì có tổng số điện tích hạt nhân là 29. Y thuộc chu kì và các nhóm nào sau đây ? A. Chu kì 3; nhóm IVA. B. Chu kì 3 ;nhóm VA. C. Chu kì 2; IVA. D. Chu kì 3 ;nhóm IIIA.
Đọc tiếp
Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì có tổng số điện tích hạt nhân là 29. Y thuộc chu kì và các nhóm nào sau đây ?
A. Chu kì 3; nhóm IVA.
B. Chu kì 3 ;nhóm VA.
C. Chu kì 2; IVA.
D. Chu kì 3 ;nhóm IIIA.
Đáp án: B
Giả sử số hiệu nguyên tử của X là Z.
Vì X và Y đứng kế tiếp nhau trong một chu kì → số hiệu nguyên tử của Y là Z + 1.
Tổng số điện tích hạt nhân là 29 → Z + Z + 1 = 29 → Z = 14.
Y có số hiệu nguyên tử = 14 + 1 = 15.
Cấu hình electron của Y là 15Y: 1s22s22p63s23p3.
X có 3 lớp electron → X thuộc chu kì 3.
X có 5 eletron hóa trị, electron cuối cùng điền vào phân lớp 3p → X thuộc nhóm VA.
Đúng 0
Bình luận (0)