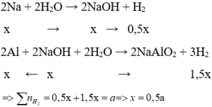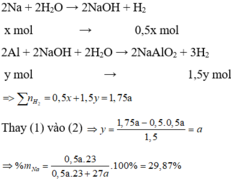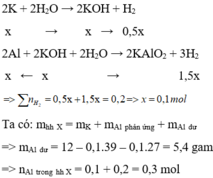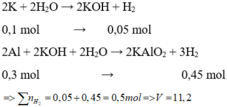Bài tập về kim loại kiềm và nhôm tác dụng với H2O
Hỗn hợp X gồm Na và Al. Cho m gam X vào một lương nước dư thì thoát ra V lít khí. Nếu cũng cho m gam X vào dung dịch NaOH dư thì được 1,75V lít khí(đktc), thành phần phần trăm theo khối lượng của Na trong X là bao nhiêu phần trăm?