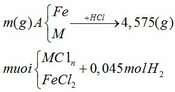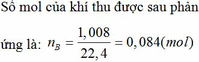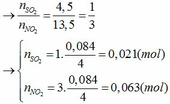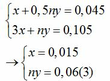Chia 59,2 g hỗn hợp kim loại M(II) ,oxit kim loại M và muối sunfat của kim loại M không đổi thành 2 phần bằng nhau .Phần 1:hòa tan hết vào trong dung dịch H2SO4 loãng thu được dung dịch A và khí B.Lượng khí B tác dụng vừa đủ với 32 g CuO.Cho dung dịch KOH dư vào dung dịch A , sau khi phản ứng kết thúc lọc lấy kết tủa nung đến khối lượng ko đổi được 28 g chất rắn.phần 2 cho tác dụng với 500 ml dung dịch CuSO4 1,2M.Sau khi phản ứng kết thúc, lọc bỏ kết tủa rồi đem phần còn lại cô cạn,làm khô thu được 92 g chất rắn.
1)Viết phương trình phản ứng xảy ra và xác định M.
2)Tính thành phần % khối lượng các chất trong hỗn hợp ban đầu biết rằng các phản ứng xảy ra hoàn toàn.