Quặng anoctit là 1 hợp chất aluminosilicat chứa 14,4% Ca; 19,4% Al, còn lại là Si, O. Tìm công thức phân tử của quặng dưới dạng oxit

Những câu hỏi liên quan
1 một kim loại X chứa 64% Fe2O3, quặng Y chứa 69,6% Fe3O4. Trộn a tấn quặng X với b tấn quặng Y thu được một loại quặng Z có thể điều chế được 481,25 kg gang chứa 4% cacbon.( Gang là hợp chất của sắt và cacbon).2 Phân hủy hoàn toàn một hợp chất A ở nhiệt độ cao theo phương trình sau: 4A nhiệt phân------ 4B+ C + 2DCác sản phẩm tạo thành đều ở thể khí. Tính tỉ khối của hỗn hợp khí sau phản ứng so với khí hidro là 18. Xác định khối lượng mol của chất A C...
Đọc tiếp
1> một kim loại X chứa 64% Fe2O3, quặng Y chứa 69,6% Fe3O4. Trộn a tấn quặng X với b tấn quặng Y thu được một loại quặng Z có thể điều chế được 481,25 kg gang chứa 4% cacbon.( Gang là hợp chất của sắt và cacbon).
2> Phân hủy hoàn toàn một hợp chất A ở nhiệt độ cao theo phương trình sau:
4A nhiệt phân------> 4B+ C + 2D
Các sản phẩm tạo thành đều ở thể khí. Tính tỉ khối của hỗn hợp khí sau phản ứng so với khí hidro là 18. Xác định khối lượng mol của chất A
Các bạn giúp tui nha cám ơn mn nhiều:))
2)
Giả sử có 1 mol A
PTHH: 4A --to--> 4B + C + 2D
1------->1-->0,25->0,5
=> nkhí sau pư = 1 + 0,25 + 0,5 = 1,75 (mol)
BTKL: mA = mB + mC + mD
Có \(\overline{M}=\dfrac{m_B+m_C+m_D}{1,75}=18.2=36\)
=> mA = 63 (g)
=> \(M_A=\dfrac{63}{1}=63\left(g/mol\right)\)
Đúng 3
Bình luận (0)
câu 1) đề có nói rõ điều chế 481,25kg gang từ bao nhiêu Z không vậy bn :) ?
Đúng 1
Bình luận (3)
1)
Giả sử a + b = 1 (tấn)
Do cacbon chiếm 4%
=> Fe chiếm 96% khối lượng gang
\(m_{Fe}=\dfrac{481,25.10^3.96}{100}=462.10^3\left(g\right)\)
=> \(n_{Fe}=\dfrac{462.10^3}{56}=8,25.10^3\left(mol\right)\)
\(m_{Fe_2O_3\left(X\right)}=\dfrac{a.10^6.64}{100}=640.10^3.a\left(g\right)\)
=> \(n_{Fe_2O_3}=\dfrac{640.10^3.a}{160}=4.10^3.a\left(mol\right)\)
\(m_{Fe_3O_4\left(Y\right)}=\dfrac{b.10^6.69,6}{100}=696.10^3.b\left(g\right)\)
=> \(n_{Fe_3O_4}=\dfrac{696.10^3.b}{232}=3.10^3.b\left(mol\right)\)
Bảo toàn Fe:
2.4.103.a + 3.3.103.b = 8,25.103
=> 8a + 9b = 8,25
Mà a + b = 1
=> a = 0,75; b = 0,25
=> \(\dfrac{a}{b}=\dfrac{0,75}{0,25}=\dfrac{3}{1}\)
Đúng 1
Bình luận (0)
X là quặng hematit đỏ chứa 64% Fe2O3 (còn lại là tạp chất không chứa nguyên tố Fe) . Y là quặng manhetit chứa 92,8% Fe3O4 ( còn lại là tạp chất không chứa nguyên tố Fe) . Trộn m1 tấn quặng X với m2 tấn quặng Y thu được 1 tấn hỗn hợp Z. Đem toàn bộ Z luyện gang, rồi luyện thép thì thu được 420,42 kg thép chứa 0,1% gồm cacbon và các tạp chất. Giả thiết hiệu suất toàn bộ quá trình là 75%. Tỉ lệ m1 : m2 là A. 2:1 B. 3:4 C. 1:1 D. 1:2
Đọc tiếp
X là quặng hematit đỏ chứa 64% Fe2O3 (còn lại là tạp chất không chứa nguyên tố Fe) . Y là quặng manhetit chứa 92,8% Fe3O4 ( còn lại là tạp chất không chứa nguyên tố Fe) . Trộn m1 tấn quặng X với m2 tấn quặng Y thu được 1 tấn hỗn hợp Z. Đem toàn bộ Z luyện gang, rồi luyện thép thì thu được 420,42 kg thép chứa 0,1% gồm cacbon và các tạp chất. Giả thiết hiệu suất toàn bộ quá trình là 75%. Tỉ lệ m1 : m2 là
A. 2:1
B. 3:4
C. 1:1
D. 1:2
1. Khi phân tích mẫu quặng apatit (chứa Ca3(PO4)2) thấy có 3,1g P. HÃy tính xem mẫu quặng đó có chứa bao nhiêu g Ca3(PO4)2?
2. Lập CTHH của chất chứa 40%S, 60%O .Biết khối lượng Mol của hợp chất này là M=80g
1.
nP=\(\dfrac{3,1}{31}=0,1\left(mol\right)\)
Ta có:
\(\dfrac{1}{2}\)nP=nCa3(PO4)2=0,05(mol)
mCa3(PO4)2=0,05.310=15,5(g)
2.
Gọi CTHH của HC là SxOy
KL Mol của S trong HC=80.\(\dfrac{40}{100}\)=32
KL Mol của O trong HC=\(80-32=48\)
=>x=\(\dfrac{32}{32}=1\)
y=\(\dfrac{48}{16}=3\)
Vậy CTHH của HC là SO3
Đúng 0
Bình luận (5)
Một quặng X chứa 64% Fe2O3 và quặng Y chứa 69,6% Fe3O4. Trộn a tấn quặng X với b tấn quặng Y thu được một loại quặng Z.Biết từ một tấn quặng Z có thể điều chế được 481,25kg gang chứa 4% cacbon( gang là hợp chất gồm Fe và C)
%Fe = 100% -4% = 96%
$m_{Fe} = 481,25.96% = 462(gam)$
$n_{Fe} = 462 : 56 = 8,25(kmol)$
Ta có : $a + b = 1(1)$
$m_{Fe_2O_3} = 1000a.64\% = 640a(kg)$
$\to n_{Fe_2O_3} = 640a : 160 = 4a(kmol)$
$m_{Fe_3O_4} = 1000b.69,6\% = 696b(kg)$
$\to n_{Fe_3O_4} = 696b : 232 = 3b(kmol)$
Bảo toàn nguyên tố với Fe :
$4a.2 + 3b.3 = 8,25(2)$
Từ (1)(2) suy ra a = 0,75(tấn) ; b = 0,25(tấn)
Đúng 3
Bình luận (0)
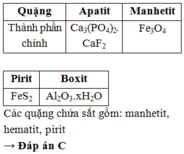
Cho các loại quặng: apatit, manhetit, hematit, pirit, boxit. Số quặng có thành phần chính chứa hợp chất của sắt là
A. 2
B. 1
C. 3
D. 4
1 người trộn 3 tấn hỗn hợp quặng chứa 45% là sắt với 7 tấn hỗn hợp quặng chứa 55% là sắt. Hỏi sẽ được hỗn hợp quặng với bao nhiêu phần trăm sắt?
Sẽ được hỗn hợp quặng với số % sắt là:
45%+55%=100%
Đ/S:100%
Đúng 0
Bình luận (0)
Từ 1 tấn quặng sắt cromit (có thể viết tắt
Fe
CrO
2
2
người ta điều chế được 216 kg hợp kim ferocrom (hợp kim Fe-Cr) có chứa 65% Cr. Giả sử hiệu suất của quá trình là 90%. Phần trăm khối lượng của của tạp chất trong quặng là A. 33,6%. B. 27,2%. C. 30,2% D. 66,4%.
Đọc tiếp
Từ 1 tấn quặng sắt cromit (có thể viết tắt Fe CrO 2 2 người ta điều chế được 216 kg hợp kim ferocrom (hợp kim Fe-Cr) có chứa 65% Cr. Giả sử hiệu suất của quá trình là 90%. Phần trăm khối lượng của của tạp chất trong quặng là
A. 33,6%.
B. 27,2%.
C. 30,2%
D. 66,4%.
Từ 1 tấn quặng sắt cromit (có thể viết tắt Fe(CrO2)2 người ta điều chế được 216 kg hợp kim ferocrom (hợp kim Fe-Cr) có chứa 65% Cr. Giả sử hiệu suất của quá trình là 90%. Thành phần %(m) của tạp chất trong quặng là A. 33,6% B. 27,2% C. 30,2% D. 66,4%
Đọc tiếp
Từ 1 tấn quặng sắt cromit (có thể viết tắt Fe(CrO2)2 người ta điều chế được 216 kg hợp kim ferocrom (hợp kim Fe-Cr) có chứa 65% Cr. Giả sử hiệu suất của quá trình là 90%. Thành phần %(m) của tạp chất trong quặng là
A. 33,6%
B. 27,2%
C. 30,2%
D. 66,4%
Từ 1 tấn quặng sắt cromit (có thể viết tắt Fe(CrO2)2 người ta điều chế được 216 kg hợp kim ferocrom (hợp kim Fe-Cr) có chứa 65% Cr. Giả sử hiệu suất của quá trình là 90%. Thành phần % khối lượng của tạp chất trong quặng là A. 33,6%. B. 27,2%. C. 30,2%. D. 66,4%.
Đọc tiếp
Từ 1 tấn quặng sắt cromit (có thể viết tắt Fe(CrO2)2 người ta điều chế được 216 kg hợp kim ferocrom (hợp kim Fe-Cr) có chứa 65% Cr. Giả sử hiệu suất của quá trình là 90%. Thành phần % khối lượng của tạp chất trong quặng là
A. 33,6%.
B. 27,2%.
C. 30,2%.
D. 66,4%.
Đáp án D
m C r = 216 . 0 , 65 = 140 , 4 k g ⇒ n C r = 2 , 7 k m o l ⇒ n F e ( C r O 2 ) 2 = 2 , 7 2 . 0 , 9 = 1 , 5 k m o l ⇒ m F e ( C r O 2 ) 2 = 336 k g % k h ố i l ư ợ n g h ợ p c h ấ t 1 - 336 1000 = 0 , 664 = 66 , 4 %
Đúng 0
Bình luận (0)