Cho thanh kim loại kẽm có khối lượng 50(g) vào dung dịch CuSO4. Tính mZn đã tham gia phản ứng

Những câu hỏi liên quan
cho thanh kim loại kẽm có khối lượng 50(g) vào dung dịch CuSO4. Sau 1 thời gian kết thúc phản ứng , khối lượng thanh kẽm là 49,82 (g) . Tính mZn đã tham gia phản ứng
Zn + CuSO4 → ZnSO4 + Cu
Khối lượng kim loại giảm là: \(50-49,82=0,18\left(g\right)\)
Gọi x là số mol Zn pư
\(\Rightarrow m_{Zn}pư=65x\left(g\right)\)
Theo PT: \(n_{Cu}=n_{Zn}=x\left(mol\right)\)
\(\Rightarrow m_{Cu}=64x\left(g\right)\)
Ta có: \(m_{Zn}pư-m_{Cu}=0,18\)
\(\Leftrightarrow65x-64x=0,18\)
\(\Leftrightarrow x=0,18\)
Vậy \(n_{Zn}pư=0,18\left(mol\right)\)
\(\Rightarrow m_{Zn}pư=0,18\times65=11,7\left(g\right)\)
Đúng 0
Bình luận (0)
Cho thanh kim loại kẽm có khối lượng 50(g) vào dung dịch CuSO4. Sau 1 thời gian kết thúc phản ứng , khối lượng thanh kẽm là 49,82 (g) . Tính mZn đã tham gia phản ứng
Zn + CuSO4 → ZnSO4 + Cu
Khối lượng kim loại giảm là: \(50-49,82=0,18\left(g\right)\)
Gọi x là số mol của Zn phản ứng
\(\Rightarrow m_{Zn}pư=65x\left(g\right)\)
Theo PT: \(n_{Cu}=n_{Zn}pư=x\left(mol\right)\)
\(\Rightarrow m_{Cu}=64x\left(g\right)\)
Ta có: \(m_{Zn}-m_{Cu}=0,18\)
\(\Leftrightarrow65x-64x=0,18\)
\(\Leftrightarrow x=0,18\)
Vậy \(n_{Zn}pư=0,18\left(mol\right)\)
\(\Rightarrow m_{Zn}pư=0,18\times65=11,7\left(g\right)\)
Đúng 0
Bình luận (0)
: Cho một thanh sắt có khối lượng 50g vào 200 ml dung dịch CuSO4 10 % (D = 1,12g/ml). Sau phản ứng nhấc thanh sắt ra rửa nhẹ, sấy khô cân được 50,4g
a. Tính khối lượng kim loại đã tham gia phản ứng và kim loại tạo thành.
b. Tính nồng độ phần trăm của chất có trong dung dịch sau phản ứng.
Nhúng thanh kim loại Mg có khối lượng m gam vào dung dịch chứa 0,2 mol
C
u
S
O
4
, sau một thời gian lấy thanh kim loại ra, thấy khối lượng
C
u
S
O
4
đã tham gia phản ứng là 80%. Thanh kim loại sau khi lấy ra đem đốt cháy trong
O
2
dư, thu được (m + 12,8) gam chất rắn (cho rằng Cu giải phóng bám hết vào thanh Mg). Khối lượng thanh kim loại sa...
Đọc tiếp
Nhúng thanh kim loại Mg có khối lượng m gam vào dung dịch chứa 0,2 mol C u S O 4 , sau một thời gian lấy thanh kim loại ra, thấy khối lượng C u S O 4 đã tham gia phản ứng là 80%. Thanh kim loại sau khi lấy ra đem đốt cháy trong O 2 dư, thu được (m + 12,8) gam chất rắn (cho rằng Cu giải phóng bám hết vào thanh Mg). Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch C u S O 4 là
A. 12,00 gam
B. 16,00 gam
C. 9,60 gam
D. 10,24 gam
Chọn đáp án B
n C u S O 4 p ư = 0 , 2 . 80 100 = 0 , 16 m o l
PTHH: M g + C u S O 4 → M g S O 4 + C u
Số mol: 0,16…0,16……..0,16
Sau phản ứng với dung dịch C u S o 4 khối lượng thanh kim loại là:
m 1 =m-24.0,16+64.0,16=m+6,4 (g)
Thanh kim loại sau khi lấy ra có x mol Mg dư và 0,16 mol Cu
Khi đốt trong oxi dư:
2 M g ⏟ x m o l + O 2 → 2 M g O
2 C u ⏟ 0 , 16 + O 2 → C u O
m O 2 (m + 12,8) – ( m + 6,4) = 6,4 → n O 2 =0,2 mol
0,5x + 0,08 = 0,2 x = 0,24 mol
Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch C u S O 4 là
0,24 . 24+ 0,16 . 64 = 16 gam
Đúng 0
Bình luận (0)
Nhúng thanh kim loại Mg có khối lượng m gam vào dung dịch chứa 0,2 mol CuSO4, sau một thời gian lấy thanh kim loại ra, thấy khối lượng CuSO4đã tham gia phản ứng là 80%. Thanh kim loại sau khi lấy ra đem đốt cháy trong O2dư, thu được (m + 12,8) gam chất rắn (cho rằng Cu giải phóng bám hết vào thanh Mg). Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch CuSO4 là A. 10,24 gam B. 12,00 gam C. 16,00 gam D. 9,60 gam
Đọc tiếp
Nhúng thanh kim loại Mg có khối lượng m gam vào dung dịch chứa 0,2 mol CuSO4, sau một thời gian lấy thanh kim loại ra, thấy khối lượng CuSO4đã tham gia phản ứng là 80%. Thanh kim loại sau khi lấy ra đem đốt cháy trong O2dư, thu được (m + 12,8) gam chất rắn (cho rằng Cu giải phóng bám hết vào thanh Mg). Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch CuSO4 là
A. 10,24 gam
B. 12,00 gam
C. 16,00 gam
D. 9,60 gam

Số mol: 0,16......0,16.............................0,16
Sau phản ứng với dung dịch CuSO4 khối lượng thanh kim loại là
![]()
Thanh kim loại sau khi lấy ra có x mol Mg dư và 0,16 mol Cu
Khi đốt trong oxi dư:
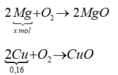
mO2 = (m + 12,8) – (m + 6,4) = 6,4 → nO2 = 0,2 mol
0,5 x + 0,08 = 0,2 → x = 0,24 mol
Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch CuSO4 là
0,24 . 24 + 0,16 . 64 = 16 gam
Đáp án C
Đúng 0
Bình luận (0)
Nhúng thanh kim loại Mg có khối lượng m gam vào dung dịch chứa 0,2 mol CuSO4, sau một thời gian lấy thanh kim loại ra, thấy khối lượng CuSO4đã tham gia phản ứng là 80%. Thanh kim loại sau khi lấy ra đem đốt cháy trong O2dư, thu được (m + 12,8) gam chất rắn (cho rằng Cu giải phóng bám hết vào thanh Mg). Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch CuSO4 là A. 10,24 gam B. 12,00 gam C. 16,00 gam D. 9,60 gam
Đọc tiếp
Nhúng thanh kim loại Mg có khối lượng m gam vào dung dịch chứa 0,2 mol CuSO4, sau một thời gian lấy thanh kim loại ra, thấy khối lượng CuSO4đã tham gia phản ứng là 80%. Thanh kim loại sau khi lấy ra đem đốt cháy trong O2dư, thu được (m + 12,8) gam chất rắn (cho rằng Cu giải phóng bám hết vào thanh Mg). Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch CuSO4 là
A. 10,24 gam
B. 12,00 gam
C. 16,00 gam
D. 9,60 gam
Bài 1: Nhúng một thanh sắt nặng 100 gam vào dung dịch CuSO4 0,1M. Sau khi phản ứng kết thúc, thấy khối lượng thanh kim loại tăng lên 101,3 gam. Hỏi:a) Có bao nhiêu gam sắt tham gia phản ứng. b) Thể tích dung dịch CuSO4 0,1M cần vừa đủ cho phản ứng trên là bao nhiêu?
Đọc tiếp
Bài 1: Nhúng một thanh sắt nặng 100 gam vào dung dịch CuSO4 0,1M. Sau khi phản ứng kết thúc, thấy khối lượng thanh kim loại tăng lên 101,3 gam. Hỏi:
a) Có bao nhiêu gam sắt tham gia phản ứng.
b) Thể tích dung dịch CuSO4 0,1M cần vừa đủ cho phản ứng trên là bao nhiêu?
a) Gọi \(n_{Fe,pứ}=a\left(a>0\right)\)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
\(m_{\uparrow}=64a-56a=101,3-100\\ \Rightarrow a=0,1625mol\\ m_{Fe,Pư}=0,1625.56=9,1g\\ b)n_{CuSO_4,pứ}=n_{Fe,pứ}=0,1625mol\\ V_{ddCuSO_4,pứ}=\dfrac{0,1625}{0,1}=1,625l\)
Đúng 2
Bình luận (0)
: Cho 9,1 gam bột kim loại kẽm tác dụng vừa đủ với dung dịch CuSO4 20% có khối lượng riêng là 1,12 g/ml
a) Tính khối lượng kim loại đồng được tạo thành sau phản ứng.
b) Tính thể tích dung dịch CuSO420% đã dùng
Đọc tiếp
: Cho 9,1 gam bột kim loại kẽm tác dụng vừa đủ với dung dịch CuSO4 20% có khối lượng riêng là 1,12 g/ml
a) Tính khối lượng kim loại đồng được tạo thành sau phản ứng.
b) Tính thể tích dung dịch CuSO420% đã dùng
\(a)n_{Zn}=\dfrac{9,1}{65}=0,14mol\\ Zn+CuSO_4\rightarrow Cu+ZnSO_4\\ n_{Cu}=n_{CuSO_4}=n_{Zn}=0,14mol\\ m_{Cu}=0,14.64=8,96g\\ b)m_{CuSO_4}=0,14.160=22,4g\\ m_{ddCuSO_4}=\dfrac{22,4}{20\%}\cdot100\%=112g\\ V_{ddCuSO_4}=\dfrac{112}{1,12}=100ml\)
Đúng 2
Bình luận (0)
Câu 3: Cho một lá đồng có khối lượng là 6 gam vào dung dịch AgNO3. Phản ứng xong,đem lá kim loại ra rửa nhẹ, làm khô cân được 13,6 gam. Tính khối lượng đồng đã phảnứng.Câu 4Nhúng thanh sắt có khối lượng 50 gam vào 400ml dung dịch CuSO4. Sau một thờigian khối lượng thanh sắt tăng 4%. . Xác định lượng Cu thoát ra. Giả sử đồng thoát ra đềubám vào thanh sắtCâu 5: Tại sao không nên dùng các vật dụng bằng nhôm để đựng nước vôi hoặc muốidưa?ai help mình với cần gấp
Đọc tiếp
Câu 3: Cho một lá đồng có khối lượng là 6 gam vào dung dịch AgNO3. Phản ứng xong,
đem lá kim loại ra rửa nhẹ, làm khô cân được 13,6 gam. Tính khối lượng đồng đã phản
ứng.
Câu 4Nhúng thanh sắt có khối lượng 50 gam vào 400ml dung dịch CuSO4. Sau một thời
gian khối lượng thanh sắt tăng 4%. . Xác định lượng Cu thoát ra. Giả sử đồng thoát ra đều
bám vào thanh sắt
Câu 5: Tại sao không nên dùng các vật dụng bằng nhôm để đựng nước vôi hoặc muối
dưa?
ai help mình với cần gấp

















